题目内容
13.简单原子的原子结构可用下图形象的表示: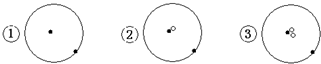
其中
 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )| A. | ①②③是三种化学性质不同的粒子 | B. | ①②③具有相同的质量数 | ||
| C. | ①②③为同素异形体 | D. | ①②③互为同位素 |
分析 从图示知①、②、③中的质子数等于电子数且都等于1,中子数分别为0、1、2;可知①②③代表的微粒分别为11H、12H、13H,
A.电子数决定化学性质,电子数=质子数;
B.质量数=质子数+中子数;
C.同种元素组成的性质不同的单质之间互为同素异形体;
D.质子数相同中子数不同的同种元素的不同原子之间互为同位素.
解答 解:从图示知①、②、③中的质子数等于电子数且都等于1,中子数分别为0、1、2;可知①②③代表的微粒分别为11H、12H、13H,
A.电子数决定化学性质,电子数=质子数,三种原子的电子数相同,化学性质相同,故A错误;
B.质量数=质子数+中子数,11H、12H、13H的质量数分别为1、2、3,则质量数不同,故B错误;
C.同种元素组成的性质不同的单质之间互为同素异形体,①②③是不同的原子,不是同素异形体,故C错误;
D.可知①②③代表的微粒分别为11H、12H、13H,质子数相同中子数不同,互为同位素,故D正确;
故选D.
点评 本题考查同位素、同素异形体的概念,难度不大.对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.

练习册系列答案
相关题目
4.图为Pt电极的氢氧燃料电池工作原理示意图,H2SO4为电解质溶液.有关说法不正确的是( )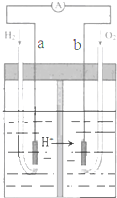

| A. | a极为负极,电子由a极流向b极 | |
| B. | a极的电极反应式是:H2-2e-=2H+ | |
| C. | 电池工作一段时间后,装置中c(H2SO4)增大 | |
| D. | 若将H2改为等物质的量CH4,O2的用量增多 |
1.下列有关氯化钠的实验中,选用的实验用品都能用到的是( )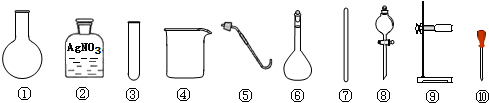

| A. | 除去粗盐中的不溶性杂质,选用 ④⑦⑧⑨ | |
| B. | 检验A的滤液中是否含SO42-,选用 ②③⑩ | |
| C. | 利用提纯后的NaCl固体配制0.1mol/L的溶液,选用 ④⑥⑦⑩ | |
| D. | 用NaCl固体与浓H2SO4共热制备HCl气体,选用 ①⑤⑧⑨ |
18.下列事实中,不能说明氯原子得电子能力比硫原子强的是( )
| A. | 盐酸的酸性比氢硫酸(H2S水溶液)酸性强 | |
| B. | Cl2与铁反应生成FeCl3,而S与铁反应生成FeS | |
| C. | Cl2能与H2S反应生成S | |
| D. | 还原性:Cl-<S2- |
5.下列物质与常用危险化学品的类别不对应的是( )
| A. | 氢氧化钠--腐蚀品 | B. | 高锰酸钾--氧化剂 | ||
| C. | 钠--遇湿易燃物品 | D. | 甲烷--易燃液体 |
 .试回答下列问题
.试回答下列问题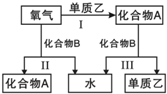 A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:
A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题: ;其水溶液呈碱性的原因是NH3+H20
;其水溶液呈碱性的原因是NH3+H20 NH4++OH-(用离子方程式表示).
NH4++OH-(用离子方程式表示).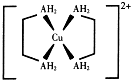 铜及其化合物在现代生活中应用广泛.
铜及其化合物在现代生活中应用广泛.