题目内容
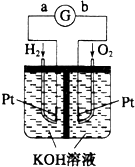
4.图为Pt电极的氢氧燃料电池工作原理示意图,H2SO4为电解质溶液.有关说法不正确的是( )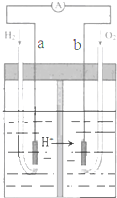
| A. | a极为负极,电子由a极流向b极 | |
| B. | a极的电极反应式是:H2-2e-=2H+ | |
| C. | 电池工作一段时间后,装置中c(H2SO4)增大 | |
| D. | 若将H2改为等物质的量CH4,O2的用量增多 |
分析 氢氧燃料电池工作时,是把化学能转变为电能,通入氢气的一极a为电源的负极,发生氧化反应,电极反应式为H2-2e-=2H+,通入氧气的一极b为原电池的正极,电极反应式为O2+4H++4e-=2H2O,电子由负极a经外电路流向正极b.
解答 解:A、氢氧燃料电池工作时,通入氢气的一极a为电源的负极,电子由负极a经外电路流向正极b,故A正确;
B、通入氢气的一极a为电源的负极,发生氧化反应,电极反应式为H2-2e-=2H+,故B正确;
C、氢氧燃料电池中,H2在负极上a被氧化,O2在正极 b上被还原,总反应为氢气与氧气燃烧生成水,所以装置中电解质溶液体积增大,c(H2SO4)减小,故C错误;
D、将H2改为等物质的量CH4,则转移电子数增大,所以O2的用量增多,故D正确;
故选C.
点评 本题考查氢氧燃料电池的工作原理,题目难度不大,注意正负极的判断及电子流动方向.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
12.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 含有大量Al3+的溶液中:Na+、NH4+、SO42-、Cl- | |
| C. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
15.下列说法中,不正确的是( )
| A. | 反应热指的是反应过程中放出的热量 | |
| B. | 原电池的负极发生氧化反应 | |
| C. | 伴随能量变化的不一定是化学变化 | |
| D. | 电解池的阳极发生氧化反应 |
12.黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图2
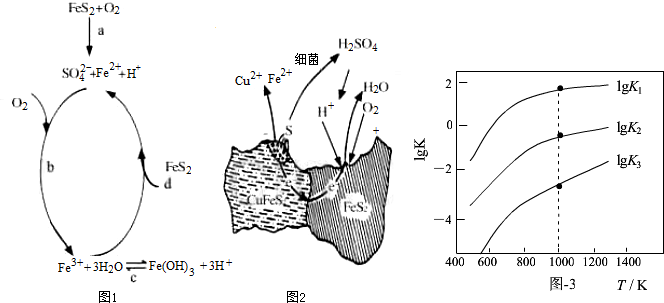
①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图3.
①上述反应中,△H1>0(选填:“>”或“<”).
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图2

①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图3.
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.
19.关于下列各装置图的叙述中,不正确的是( )
| A. | 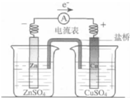 图中总反应为Zn+CuSO4═Cu+ZnSO4 | |
| B. | 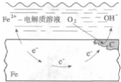 图中正极反应为2H2O+O 2+4e-═4OH- | |
| C. | 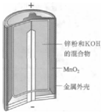 图中负极反应为Zn+2OH--2e-═Zn(OH)2 | |
| D. |  图中向Fe电极区滴入2滴铁氰化钾溶液产生蓝色沉淀 |
16.如图,下列装置属于原电池的是( )
| A. | 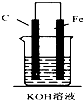 | B. | 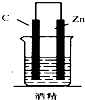 | C. | 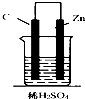 | D. |  |
13.简单原子的原子结构可用下图形象的表示:
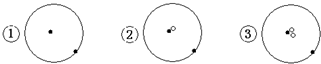
其中 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )

其中
 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )| A. | ①②③是三种化学性质不同的粒子 | B. | ①②③具有相同的质量数 | ||
| C. | ①②③为同素异形体 | D. | ①②③互为同位素 |
14.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,Y原子的核外电子数是内层电子的4倍,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
| A. | 元素Q的最高价氧化物对应的水化物酸性比W的强 | |
| B. | 化合物W2Q2中,各原子最外层均达8电子结构 | |
| C. | 工业上通过电解Z与Q形成的化合物制备Z单质 | |
| D. | Y单质与X的气态氢化物可发生置换反应 |
 (1)下列过程中不一定释放能量的是AB(请填编号)
(1)下列过程中不一定释放能量的是AB(请填编号)