题目内容
3.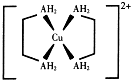 铜及其化合物在现代生活中应用广泛.
铜及其化合物在现代生活中应用广泛.(1)用黄铜矿炼铜的最后一步反应为:Cu2S+2Cu2O$\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑
①硫元素的基态原子核外电子排布式为ls22s22p63s23p4.
②铜元素的电离能:I1<I2 (填“>“或“<“).
③反应中形成的化学键类型为金属键、共价键.
(2)硫酸铜与有机物X按1:2反应生成配合物M,其配离子结构如图.已知A为第二周期元素.
①配合物M的晶体类型为离子晶体.
②构成配离子的元素中,有两种元素基态原子未成对电子数相同,这两种元素的电负性从大到小的顺序是H>Cu(填元素符号).
③1mo1有机物X中含σ键的数目为11NA.
(3)Cu2+在生成[Cu(NH3)4]2+时,核外3d轨道上的1个未成对电子跃迁到4p轨道上,则Cu2+的轨道杂化方式不是sp3的原因是因4p已有1个电子,若形成sp3杂化轨道,无法提供4个空轨道形成4个配位键.
分析 (1)①硫元素原子核外电子数为16,根据能量最低原理书写基态原子核外电子排布式;
②Cu的第一电离能为失去4s能级电子需要能量,第二电离能失去3d能级1个电子需要能量,3d为全满稳定状态,能量较低;
③反应生成Cu与二氧化硫,Cu为金属晶体,二氧化硫为共价化合物;
(2)①配合物M由配离子与硫酸根构成;
②构成配离子的元素中,有两种元素基态原子未成对电子数相同,应是H元素与Cu,未成对电子数均为1,非金属性越强,电负性越大;
③A为第二周期元素,由配离子结构可知,A成3个共价键且与铜离子形成配位键,故A为N元素,该有机物X为H2NCH2CH2NH2;
(3)核外3d轨道上的1个未成对电子跃迁到4p轨道上,若形成sp3杂化轨道,无法提供4个空轨道.
解答 解:(1)①硫元素原子核外电子数为16,根据能量最低原理,其基态原子核外电子排布式为ls22s22p63s23p4,
故答案为:ls22s22p63s23p4;
②Cu的第一电离能为失去4s能级电子需要能量,第二电离能失去3d能级1个电子需要能量,3d为全满稳定状态,能量较低,故铜元素的电离能:I1<I2,
故答案为:<;
③反应生成Cu与二氧化硫,Cu为金属晶体,存在金属键,二氧化硫为共价化合物,含有共价键,
故答案为:金属键、共价键;
(2)①配合物M由配离子与硫酸根构成,属于离子化合物,
故答案为:离子化合物;
②构成配离子的元素中,有两种元素基态原子未成对电子数相同,应是H元素与Cu,未成对电子数均为1,非金属性越强,电负性越大,故电负性H>Cu,
故答案为:H>Cu;
③A为第二周期元素,由配离子结构可知,A成3个共价键且与铜离子形成配位键,故A为N元素,该有机物X为H2NCH2CH2NH2,分子中含有2个C-N键、1个C-C键、4个C-H键、4个N-NH键,故1mo1有机物X中含σ键的数目为11NA,
故答案为:11NA;
(3)核外3d轨道上的1个未成对电子跃迁到4p轨道上,因4p已有1个电子,若形成sp3杂化轨道,无法提供4个空轨道形成4个配位键,
故答案为:因4p已有1个电子,若形成sp3杂化轨道,无法提供4个空轨道形成4个配位键.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、化学键、配合物等,是对学生综合能力的考查,难度中等.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
其中
 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )| A. | ①②③是三种化学性质不同的粒子 | B. | ①②③具有相同的质量数 | ||
| C. | ①②③为同素异形体 | D. | ①②③互为同位素 |
| A. | 元素Q的最高价氧化物对应的水化物酸性比W的强 | |
| B. | 化合物W2Q2中,各原子最外层均达8电子结构 | |
| C. | 工业上通过电解Z与Q形成的化合物制备Z单质 | |
| D. | Y单质与X的气态氢化物可发生置换反应 |
①反应刚开始,仅有少量气泡产生;
②反应片刻后,有大量气泡产生;
③试管底部最终出现红褐色沉淀.下列判断正确的是( )
| A. | ①中仅发生一个反应 | |
| B. | Fe3+能催化H2O2的分解 | |
| C. | 反应过程中溶液pH不断减小 | |
| D. | FeSO4与等物质的量的H2O2恰好反应 |
| A. | 0.1 mo1 Na2O2所含的阴离子 | |
| B. | 1 L0.1 mol•L-1氨水中的NH${\;}_{4}^{+}$ | |
| C. | 12.5mL 16 mo1•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6g N02气体所含的分子 |
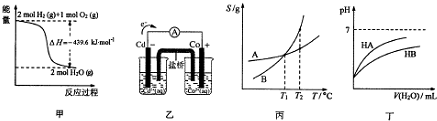
| A. | 由甲推知氢气的燃烧热为219.8kJ•mol-1 | |
| B. | 由乙推知离子反应Co2+(ap)+Cd(s)═Co(s)+Cd2+(ap)可以发生 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温T2℃时,溶质的质量分数:B>A | |
| D. | 由丁可知:同温度、同浓度NaA溶液与NaB溶液相比,其pH:NaA>NaB |
| A. | 1L 1 mol•L-1盐酸中含有nA个HCl分子 | |
| B. | 32g O2与O3的混合物含有2nA个氧原子 | |
| C. | 1L 1 mol•L-1CuCl2溶液中含有nA个Cu2+ | |
| D. | 1mol Na与足量Cl2反应,转移2nA个电子 |
 (1)K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是配位键,基态Fe2+的电子排布式1s22s22p63s23p63d6 或[Ar]3d6 ,1molCN-中含有π键的数目为2NA.
(1)K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是配位键,基态Fe2+的电子排布式1s22s22p63s23p63d6 或[Ar]3d6 ,1molCN-中含有π键的数目为2NA.