题目内容
2.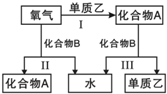 A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:
A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:(1)如图三个反应中,属于氧化还原反应的有3个.
(2)若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有A、C.
A.还原性:H2R>H2OB.酸性:H2R>H2O
C.稳定性:H2R<H2OD.沸点:H2R<H2O
(3)若化合物B常温下为气体,其水溶液呈碱性(答题必须用具体物质表示).
①化合物B的电子式为
 ;其水溶液呈碱性的原因是NH3+H20
;其水溶液呈碱性的原因是NH3+H20 NH4++OH-(用离子方程式表示).
NH4++OH-(用离子方程式表示).②化合物B可与O2组成燃料电池(氢氧化钾溶液为电解质溶液),其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式2NH3-6e-+6OH-=N2+6H2O.
③当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为△H1和△H2,则反应Ⅰ的热化学方程式为N2(g)+O2(g)=2NO(g)△H=0.8(△H1-△H2)(注:反应条件相同、所有物质均为气体).
分析 (1)A、B是中学化学常见的化合物,它们各由两种元素组成,乙为元素R组成的单质,反应Ⅰ、Ⅱ为有氧气参加的反应,应为氧化还原反应,反应Ⅲ由化合物A、B反应生成单质,也应为氧化还原反应;
(2)元素R与氧同主族,则R为硫元素,硫的非金属性弱于氧,根据元素周期律判断;
(3)若化合物B常温下为气体,其水溶液呈碱性,则B为NH3,根据转化关系可知,A为NO,乙为N2,据此答题.
解答 解:(1)A、B是中学化学常见的化合物,它们各由两种元素组成,乙为元素R组成的单质,反应Ⅰ、Ⅱ为有氧气参加的反应,应为氧化还原反应,反应Ⅲ由化合物A、B反应生成单质,也应为氧化还原反应,所以属于氧化还原反应的有Ⅰ、Ⅱ、Ⅲ,共3个,
故答案为:3;
(2)元素R与氧同主族,则R为硫元素,硫的非金属性弱于氧,根据元素周期律可知,能说明S与氧的非金属性相对强弱的有,还原性:H2R>H2O、稳定性:H2R<H2O,
故答案为:A、C;
(3)若化合物B常温下为气体,其水溶液呈碱性,则B为NH3,根据转化关系可知,A为NO,乙为N2,
①化合物B的电子式为 ;其水溶液呈碱性的原因是氨水电离产生氢氧根离子,离子方程式为NH3+H20
;其水溶液呈碱性的原因是氨水电离产生氢氧根离子,离子方程式为NH3+H20 NH4++OH-,
NH4++OH-,
故答案为: ;NH3+H20
;NH3+H20 NH4++OH-;
NH4++OH-;
②化合物NH3与O2组成燃料电池(氢氧化钾溶液为电解质溶液),电池负极为氨气发生氧化反应生成氮气和水,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
③当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为△H1和△H2,根据盖斯定律,将反应反应(Ⅰ-Ⅱ)×$\frac{4}{5}$可得反应Ⅰ的热化学方程式为N2(g)+O2(g)=2NO(g)△H=0.8(△H1-△H2),
故答案为:N2(g)+O2(g)=2NO(g)△H=0.8(△H1-△H2).
点评 本题考查了无机物转化关系的分析推断,依据化学反应类型,结合物质性质和相互转化关系分析判断是解题关键,题目难度中等.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图2
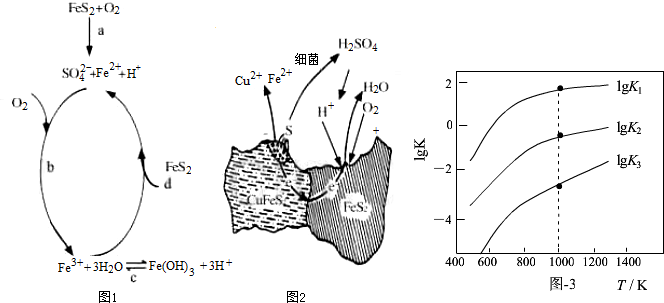
①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图3.
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.
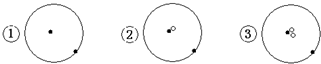
其中
 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )| A. | ①②③是三种化学性质不同的粒子 | B. | ①②③具有相同的质量数 | ||
| C. | ①②③为同素异形体 | D. | ①②③互为同位素 |
| A. | 雾霾是一种自然现象,对人体健康影响不大 | |
| B. | PM2.5是指大气中直径小于或等于2.5μm的颗粒物 | |
| C. | 大气中SO2含量的增加会导致温室效应加剧 | |
| D. | 酸雨是pH小于7的雨水 |
| A. | 二氧化碳和环氧丙烷在催化剂作用下可生成一种可降解的高聚物 | |
| B. | 化石燃料的燃烧和含硫金属矿石的冶炼等都是造成SO2污染的重要原因 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 氟氯烃的大量使用会破坏臭氧层,火箭、导弹将大量废气排放到高空,也会加速臭氧分解 |
| A. | 元素Q的最高价氧化物对应的水化物酸性比W的强 | |
| B. | 化合物W2Q2中,各原子最外层均达8电子结构 | |
| C. | 工业上通过电解Z与Q形成的化合物制备Z单质 | |
| D. | Y单质与X的气态氢化物可发生置换反应 |
①反应刚开始,仅有少量气泡产生;
②反应片刻后,有大量气泡产生;
③试管底部最终出现红褐色沉淀.下列判断正确的是( )
| A. | ①中仅发生一个反应 | |
| B. | Fe3+能催化H2O2的分解 | |
| C. | 反应过程中溶液pH不断减小 | |
| D. | FeSO4与等物质的量的H2O2恰好反应 |
| A. | 1L 1 mol•L-1盐酸中含有nA个HCl分子 | |
| B. | 32g O2与O3的混合物含有2nA个氧原子 | |
| C. | 1L 1 mol•L-1CuCl2溶液中含有nA个Cu2+ | |
| D. | 1mol Na与足量Cl2反应,转移2nA个电子 |
 铁及其化合物在国民经济的发展中起着重要作用.
铁及其化合物在国民经济的发展中起着重要作用.