题目内容
18.下列事实中,不能说明氯原子得电子能力比硫原子强的是( )| A. | 盐酸的酸性比氢硫酸(H2S水溶液)酸性强 | |
| B. | Cl2与铁反应生成FeCl3,而S与铁反应生成FeS | |
| C. | Cl2能与H2S反应生成S | |
| D. | 还原性:Cl-<S2- |
分析 非金属性越强,得电子能力越强,比较非金属性可通过以下角度:①氢化物的稳定性,②与氢气反应的难易程度,③最高价氧化物对应的水化物的酸性,④单质之间的置换反应,⑤对应阴离子的还原性强弱,⑥与变价金属反应的化合价高低等.
解答 解:A.氢化物的酸性不能用来比较非金属性强弱,例如HCl水溶液的酸性比HI的弱,但Cl的非金属性比I强,故A错误;
B.Cl2与铁反应生成FeCl3,而S与铁反应生成FeS,说明Cl原子得电子能力强,故B正确;
C.Cl2能与H2S反应生成S,说明氯气的氧化性比S强,单质的氧化性越强,对应的元素的非金属性越强,故C正确;
D.元素的非金属性越强,对应阴离子的还原性越弱,还原性:Cl-<S2-,则氯原子得电子能力比硫原子强,故D正确.
故选A.
点评 本题考查非金属性的比较,题目难度不大,注意把握比较的角度,注意氢化物的酸性不能用来比较非金属性强弱.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
6.下列不属于化学电源的是( )
| A. | 干电池 | B. | 锂电池 | C. | 太阳能电池 | D. | 铅蓄电池 |
13.简单原子的原子结构可用下图形象的表示:
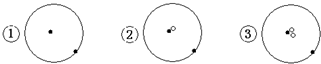
其中 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )

其中
 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )| A. | ①②③是三种化学性质不同的粒子 | B. | ①②③具有相同的质量数 | ||
| C. | ①②③为同素异形体 | D. | ①②③互为同位素 |
10.化学与环境密切相关,下列有关说法正确的是( )
| A. | 雾霾是一种自然现象,对人体健康影响不大 | |
| B. | PM2.5是指大气中直径小于或等于2.5μm的颗粒物 | |
| C. | 大气中SO2含量的增加会导致温室效应加剧 | |
| D. | 酸雨是pH小于7的雨水 |
7.下列说法错误的是( )
| A. | 二氧化碳和环氧丙烷在催化剂作用下可生成一种可降解的高聚物 | |
| B. | 化石燃料的燃烧和含硫金属矿石的冶炼等都是造成SO2污染的重要原因 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 氟氯烃的大量使用会破坏臭氧层,火箭、导弹将大量废气排放到高空,也会加速臭氧分解 |
8.读图、读表是高中学生需要具备的重要能力.下列关于各图象的解读正确的是( )
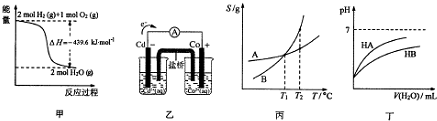

| A. | 由甲推知氢气的燃烧热为219.8kJ•mol-1 | |
| B. | 由乙推知离子反应Co2+(ap)+Cd(s)═Co(s)+Cd2+(ap)可以发生 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温T2℃时,溶质的质量分数:B>A | |
| D. | 由丁可知:同温度、同浓度NaA溶液与NaB溶液相比,其pH:NaA>NaB |
 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: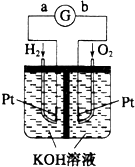 (1)下列过程中不一定释放能量的是AB(请填编号)
(1)下列过程中不一定释放能量的是AB(请填编号)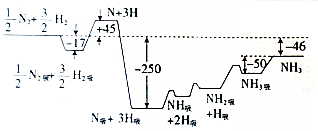 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.