题目内容
8.设计一种以反应Fe+2FeCl3=3FeCl2为原理的原电池,要求在框中画出装置图:(标明电极材料、电解质溶液、电池的正负极及电子流动的方向.)分析 由方程式可知,Fe被氧化,为原电池的负极,则正极可为碳棒或者铜,电解质溶液为氯化铁溶液,正极发生还原反应,负极发生氧化反应,以此解答该题.
解答 解:由方程式Fe+2FeCl3=3FeCl2可知,Fe被氧化,为原电池的负极,负极反应为fE-2e-=Fe2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
则正极可为碳棒或者铜,电解质溶液为氯化铁,
则原电池装置图可设计为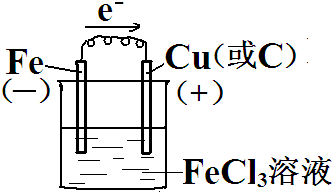 ,
,
答:原电池为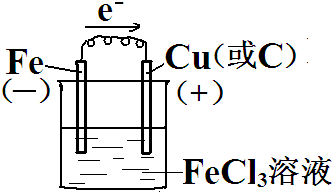 ;
;
点评 本题考查了原电池的设计,原电池的设计关键是负极材料和电解质溶液的成分,一般来说,还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液.

练习册系列答案
相关题目
16.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 透明溶液中:K+、Cu2+、SO42-、Cl- | |
| B. | KI水溶液中:K+、NO3-、SO42-、H+ | |
| C. | 使紫色石蕊试液变蓝色的溶液:K+、Na+、HS-、Cl- | |
| D. | 水电离出的c(H+)=1×10-14mol•L-1的溶液:K+、NH4+、AlO2-、Br- |
19.关于下列各装置图的叙述中,不正确的是( )
| A. | 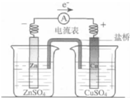 图中总反应为Zn+CuSO4═Cu+ZnSO4 | |
| B. | 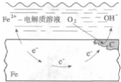 图中正极反应为2H2O+O 2+4e-═4OH- | |
| C. | 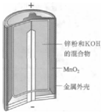 图中负极反应为Zn+2OH--2e-═Zn(OH)2 | |
| D. |  图中向Fe电极区滴入2滴铁氰化钾溶液产生蓝色沉淀 |
16.如图,下列装置属于原电池的是( )
| A. | 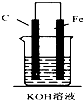 | B. | 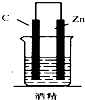 | C. | 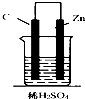 | D. |  |
3.已知金刚石的燃烧热为395kJ/mol,下表是部分化学键的键能数据.下列选项中正确的是( )
| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | x=794.5 | |
| B. | x=1142.5 | |
| C. | 1mol金刚石的能量一定比1mol CO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为 2C(s)+O2(g)=2CO(g)△H=-790 kJ/mol |
13.简单原子的原子结构可用下图形象的表示:
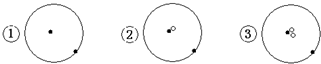
其中 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )

其中
 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )| A. | ①②③是三种化学性质不同的粒子 | B. | ①②③具有相同的质量数 | ||
| C. | ①②③为同素异形体 | D. | ①②③互为同位素 |
20.下列说法中正确的是( )
| A. | CH3COOH和CH3COONH4都是弱电解质 | |
| B. | Na2O2既含离子键又含共价键 | |
| C. | HBr、HCl、HF的酸性依次增强 | |
| D. | 二氧化硅有导电性,可用于制备光导纤维 |
18.下列物质所含粒子数为0.1NA(NA为阿伏加德罗常数的值)的是( )
| A. | 0.1 mo1 Na2O2所含的阴离子 | |
| B. | 1 L0.1 mol•L-1氨水中的NH${\;}_{4}^{+}$ | |
| C. | 12.5mL 16 mo1•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6g N02气体所含的分子 |
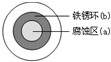 铁及其化合物在国民经济的发展中起着重要作用.
铁及其化合物在国民经济的发展中起着重要作用.