题目内容
19.下列说法正确的是( )| A. | 钠原子失去一个电子后,它的电子数与氖原子相同,所以变成氖原子 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们是互为同位素 |
分析 A、钠失去一个电子成为钠离子,和氖原子不同;
B、氢元素的一种原子:氕,是不含有中子的原子;
C、根据核素、元素、同位素的概念和内涵进行解答;
D、同位素是质子数形同,而中子数不同的同种元素的不同原子之间的互称.
解答 解:A、钠失去一个电子成为钠离子,它的电子数与氖原子相同均使10,但是钠离子绝不是氖原子,故A错误;
B、氕是不含有中子的原子,故B错误;
C、核素是指具有一定数目质子和一定数目中子的一种原子,具有相同质子数,不同中子数同一元素的不同原子互为同位素,核素间互称同位素,元素是质子数(即核电荷数)相同的一类原子的总称,元素包含同位素,故C正确;
D、同位素是质子数形同,而中子数不同的同种元素的不同原子之间的互称,4018Ar、4019K、4020Ca的质量数相同,不能说明质子数和中子数之间的关系,故D错误,
故选C.
点评 本题主要考查了有关的化学概念,深入理解各种概念的含义是解答这类题的关键,注意把握电子排布规律,题目难度不大.

练习册系列答案
相关题目
9.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 22.4L的二氧化硫气体中含有的氧原子数为2NA | |
| C. | 1.0L 1.0mol•L-1CH3COOH溶液中含有的CH3COOH分子数为NA | |
| D. | 1 mol OH-离子中含有的质子数为10NA |
10.下列反应过程中,△H>0且△S>0的是( )
| A. | CaCO3(s)═CaO(s)+CO2(g) | B. | NH3(g)+HCl(g)═NH4Cl(s) | ||
| C. | 4Al(s)+3O2(g)═2Al2O3(s) | D. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l) |
7.检验二氧化硫中是否含有二氧化碳,应采用的方法是( )
| A. | 通过澄清石灰水 | |
| B. | 先通过碳酸氢钠溶液,再通过澄清石灰水 | |
| C. | 通过品红溶液 | |
| D. | 先通过足量的溴水,再通过澄清石灰水 |
14.15L NO2和NO的混合气体通过水后收集到7L气体(同温同压),则被氧化的NO2体积( )
| A. | 4L | B. | 6L | C. | 8L | D. | 12L |
4.某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:用10ml H2O2制取150ml(标准状况下)O2所需的时间(s):
①该小组在设计方案时,考虑了浓度、温度、催化剂等因素对H2O2分解速率的影响.
②推测t的范围为480℃~720℃.
(2)将质量相同但聚集状态不同的MnO2分别加入15ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
①写出上述实验中发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②实验结果表明,催化剂的催化效果与催化剂的聚集状态(或表面积)有关.
③写出常见的另一种制取氧气的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:用10ml H2O2制取150ml(标准状况下)O2所需的时间(s):
| 浓度 反应条件 时间(s) | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360℃ | 480℃ | t℃ | 720℃ |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
②推测t的范围为480℃~720℃.
(2)将质量相同但聚集状态不同的MnO2分别加入15ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所 需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②实验结果表明,催化剂的催化效果与催化剂的聚集状态(或表面积)有关.
③写出常见的另一种制取氧气的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
11.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 常温常压下,11.2L氯气含有的分之数为0.5NA | |
| B. | 常温常压下,1mol氮气含有的质子数为7NA | |
| C. | 在标准状态下,22.4LH2O含有的原子数目为3NA | |
| D. | 32gO2所含原子数目为2NA |
8.对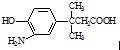 的表述不正确的是( )
的表述不正确的是( )
 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生缩聚反应 | |
| B. | 该物质有7种不同环境的氢原子 | |
| C. | 该物质遇FeCl3溶液显色,1mol该物质最多能与含1mol Br2的溴水发生取代反应 | |
| D. | 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
20.为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色Ag.(夹持及加热仪器均省略)
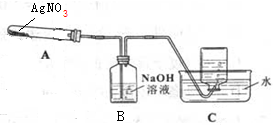
(1)如何检验装置的气密性?连接好仪器后在未加药品之前加热试管,如果C中导气管有气泡冒出,说明气密性良好.
(2)C中集气瓶收集的气体为O2.要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(3)AgNO3分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
(4)甲同学认为仅凭试管A中的红棕色的气体产生就判定NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排尽装置中的空气.你是否同甲的观点?并说明理由否,硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe3+.
假设二:Fe被氧化成Fe2+.
假设三:Fe被氧化成Fe3+或Fe2+.
可选用的试剂:KSCN溶液、酸性KMnO4溶液,氨水,盐酸,硝酸,NaCl溶液
请完成下表:
实验结论:Fe的氧化物为Fe2+和Fe3+.
Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色Ag.(夹持及加热仪器均省略)

(1)如何检验装置的气密性?连接好仪器后在未加药品之前加热试管,如果C中导气管有气泡冒出,说明气密性良好.
(2)C中集气瓶收集的气体为O2.要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(3)AgNO3分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
(4)甲同学认为仅凭试管A中的红棕色的气体产生就判定NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排尽装置中的空气.你是否同甲的观点?并说明理由否,硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe3+.
假设二:Fe被氧化成Fe2+.
假设三:Fe被氧化成Fe3+或Fe2+.
可选用的试剂:KSCN溶液、酸性KMnO4溶液,氨水,盐酸,硝酸,NaCl溶液
请完成下表:
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | - | 除尽Ag+ |
| (2)取少量上述溶液于试管中加入KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上述溶液于试管中,加入酸性KMnO4溶液,振荡 | 紫色消失 | 存在Fe2+ |