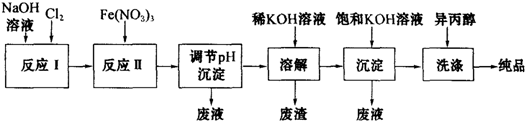
题目内容
10.下列反应过程中,△H>0且△S>0的是( )| A. | CaCO3(s)═CaO(s)+CO2(g) | B. | NH3(g)+HCl(g)═NH4Cl(s) | ||
| C. | 4Al(s)+3O2(g)═2Al2O3(s) | D. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l) |
分析 一般来说,物质的分解反应为吸热反应,△H>0,应生成较多气体,物质的混乱度增大,△S>0,以此解答.
解答 解:A.反应为吸热反应,且固体生成气体,则△H>0,△S>0,故A正确;
B.反应为放热反应,气体生成固体,则△H<0,△S<0,故B错误;
C.反应为放热反应,且气体生成固体,则△H<0,△S<0,故C错误;
D.中和反应为放热反应,△H<0,故D错误.
故选A.
点评 本题考查焓变与熵变,侧重于基础知识的考查,注意常见吸热反应和放热反应,把握物质的聚集状态与熵变的关系,题目难度不大.

练习册系列答案
相关题目
20.根据有机化合物的命名原则,下列命名正确的是( )
| A. | 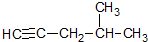 4-甲基-1,2-戊炔 4-甲基-1,2-戊炔 | |
| B. | CH3 CH (CH3)CH=CHCH32-甲基-3-戊烯 | |
| C. | 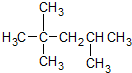 2,2,3-甲基戊烷 2,2,3-甲基戊烷 | |
| D. | 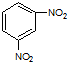 间二硝基苯 间二硝基苯 |
18.已知有机物甲、乙、丙有如下信息:
据此推断:
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为 .
.
(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含电子数 | 26 | ||
| 结构特点 | 饱和有机物 | ||
(1)甲的分子式为C3H8,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有4种.
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂.其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为
 .
.(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为C2H5F.
5.碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH.电池放电时,负极上发生反应的物质是( )
| A. | Zn | B. | 碳棒 | C. | MnO2 | D. | MnO2和H2O |
15.设NA为阿伏加德罗常数.下列叙述不正确的是( )
| A. | 标准状况下,22.4 L O3含有分子的数目为NA | |
| B. | 常温常压下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| D. | 标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1NA |
2.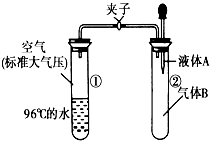 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 水、氨气 | ||
| C. | 氢氧化钠溶液、一氧化氮 | D. | 水、二氧化氮 |
19.下列说法正确的是( )
| A. | 钠原子失去一个电子后,它的电子数与氖原子相同,所以变成氖原子 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们是互为同位素 |
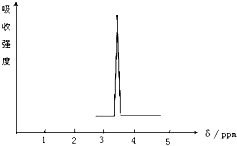 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).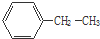 乙苯
乙苯