题目内容
14.15L NO2和NO的混合气体通过水后收集到7L气体(同温同压),则被氧化的NO2体积( )| A. | 4L | B. | 6L | C. | 8L | D. | 12L |
分析 NO2和NO的混合气体通入水后发生反应为3NO2+H2O=2HNO3+NO,导致气体体积减小,计算出体积变化量,根据体积差量法计算NO2的体积,再根据二氧化氮与水的反应方程式判断被氧化的二氧化氮的体积.
解答 解:反应后体积减小为15L-7L=8L,则:
3NO2+H2O=2HNO3+NO 体积减小△V
3 2
V(NO2) 8L
解得:V(NO2)=$\frac{8L×3}{2}$=12L,
根据反应3NO2+H2O=2HNO3+NO可知,二氧化氮被氧化生成硝酸,参加反应的二氧化氮中被氧化的占参加反应的二氧化氮$\frac{2}{3}$,
则被氧化的二氧化氮的体积为:12L×$\frac{2}{3}$=8L,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确反应原理及差量法的应用为解答关键,注意掌握氧化还原反应中反应类型的判断方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
4.下列有关实验现象的描述不正确的是( )
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 用铜板做电极电解硫酸铜溶液,阴极铜板质量增加 | |
| C. | 把铜片插入氯化铁溶液中,加入几滴氯化铜溶液,气泡放出的速率加大 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出的速率加大 |
5.碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH.电池放电时,负极上发生反应的物质是( )
| A. | Zn | B. | 碳棒 | C. | MnO2 | D. | MnO2和H2O |
2.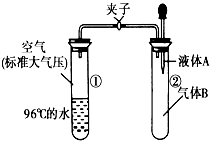 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 水、氨气 | ||
| C. | 氢氧化钠溶液、一氧化氮 | D. | 水、二氧化氮 |
9.既不能用浓硫酸干燥,又不能用碱石灰干燥的是( )
| A. | NH3 | B. | H2S | C. | SO2 | D. | HCl |
19.下列说法正确的是( )
| A. | 钠原子失去一个电子后,它的电子数与氖原子相同,所以变成氖原子 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们是互为同位素 |
6.为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是( )
| A. | NaHCO3溶液(Na2CO3),应通入过量的CO2气体 | |
| B. | NaBr溶液(NaI),应加入适量的氯水、CCl4,进行萃取分液 | |
| C. | NH4Cl溶液(FeCl3),应加入适量的氨水,过滤 | |
| D. | CO2(CO),通过过量的灼热的氧化铜粉末 |
3. 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mo N2(g)和1mo O2(g)完全反应放出的能量为180kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1molO2(g)具有的总能量小于2molN(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
15.某学习小组对Cl2与FeCl2和KSCN混合溶液的反应进行探究.
(1)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(2)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(3)为探究现象2产生的原因,该小组进行如下实验:
①取A中黄色溶液少许于试管中,加入NaOH溶液,有红褐色沉淀生成,则原溶液中一定存在Fe3+.
②取A中黄色溶液少许于试管中,加入过量的KSCN溶液,最终得到红色溶液.该小组同学此得出结论:产生现象2的原因是SCN-与Cl2发生了反应.
(4)该小组同学猜想SCN-可能被Cl2氧化了,于是又进行了如下探究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是S元素.
②在实验中SCN-中氮元素被氧化为NO3-,检验NO3-存在的方法是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,则证明SCN-中氮元素被氧化为NO3-.
③已知SCN-中各原子均满足8电子稳定结构,试写出SCN-的电子式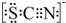 .
.
(5)若SCN-与Cl2反应生成1molCO2,则转移的电子数是16mol.
| 操作 | 现象 |
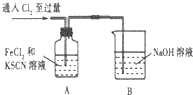 | 1.A中溶液变红 2.稍后,A中溶液由红色变为黄色 |
(2)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(3)为探究现象2产生的原因,该小组进行如下实验:
①取A中黄色溶液少许于试管中,加入NaOH溶液,有红褐色沉淀生成,则原溶液中一定存在Fe3+.
②取A中黄色溶液少许于试管中,加入过量的KSCN溶液,最终得到红色溶液.该小组同学此得出结论:产生现象2的原因是SCN-与Cl2发生了反应.
(4)该小组同学猜想SCN-可能被Cl2氧化了,于是又进行了如下探究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是S元素.
②在实验中SCN-中氮元素被氧化为NO3-,检验NO3-存在的方法是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,则证明SCN-中氮元素被氧化为NO3-.
③已知SCN-中各原子均满足8电子稳定结构,试写出SCN-的电子式
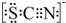 .
.(5)若SCN-与Cl2反应生成1molCO2,则转移的电子数是16mol.