题目内容
12.某原电池总反应的离子方程式为:2Fe3++Fe═3Fe2+,能实现该反应的原电池是( )| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为FeSO4溶液 | |
| C. | 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Cu,电解质溶液为CuSO4溶液 |
分析 根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐,据此分析解答.
解答 解:根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐,
A.铁作负极,铜作正极,电解质为可溶性的氯化铁,则符合题意,故A选;
B.铁作负极,碳作正极,电解质为FeSO4溶液,不能发生氧化还原反应,不则符合题意,故B不选;
C.Zn作负极,Fe作正极,电解质为可溶性的硫酸铁,所以不能构成该条件下的原电池,则不符合题意,故C不选;
D.Cu作负极,银作正极,电解质为CuSO4溶液,不能发生氧化还原反应,不能构成该条件下的原电池,故D不选;
故选A.
点评 本题考查了原电池中正负极及电解质溶液的判断,根据得失电子判断正负极及电解质,难度中等.

练习册系列答案
相关题目
2.下列关于能源和作为能源的物质的叙述中错误的是( )
| A. | 化石能源物质内部蕴储着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 物质的化学能可以在不同条件下转为热能、电能为人类所利用 | |
| D. | 我国经济发展要全部依靠化石能源 |
20.有机物原子的共线及共面问题比较重要.在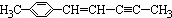 分子中,可能处于同一平面上的原子数最多为( )
分子中,可能处于同一平面上的原子数最多为( )
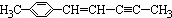 分子中,可能处于同一平面上的原子数最多为( )
分子中,可能处于同一平面上的原子数最多为( )| A. | 12个 | B. | 22个 | C. | 16个 | D. | 20个 |
7.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,
(3)写出⑤的最高价氧化物跟⑨的最高价氧化物的水化物在水溶液中反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)写出②最低价氢化物跟它的氧化物的水化物形成的所有化合物的化学式NH4NO3、NH4NO2,该化合物中含有的化学键有离子键和共价键.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,
(3)写出⑤的最高价氧化物跟⑨的最高价氧化物的水化物在水溶液中反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)写出②最低价氢化物跟它的氧化物的水化物形成的所有化合物的化学式NH4NO3、NH4NO2,该化合物中含有的化学键有离子键和共价键.
17.某粒子用ZARn+表示,下列关于该粒子的叙述中,正确的是( )
| A. | 所含的质子数=A-n | B. | 所含电子数=Z+n | ||
| C. | 所含的中子数=A-Z | D. | 质量数=Z+A |
4.下列有关热化学方程式及其叙述正确的是( )
| A. | 氢气的燃烧热为-285.5kJ/mo1,则电解水的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5kJ/mo1 | |
| B. | 1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,则它的热化学方程式为:$\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(1)△H=-445kJ/mol | |
| C. | 已知:2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则C的燃烧热为-110.5kJ/mo1 | |
| D. | HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol |
1.已知25℃时有关弱电解质的电离平衡常数如表:
根据表中数据回答下列问题:
(1)CH3COO-、CN-、CO32-结合质子(即H+)的能力大小顺序CO32->CN->CH3COO-;25℃时,有等浓度的①CH3COONa溶液、②NaCN溶液、③NaHCO3溶液,三种溶液的pH由大到小的顺序为②>③>① (填序号).
(2)Na2CO3水溶液呈碱性的原因,用离子方程式表示:CO32-+H2O?HCO3-+OH-,溶液中各离子浓度大小顺序:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
(3)NaCN溶液中通入少量二氧化碳,反应的离子方程式为CO2+CN-+H2O=HCN+HCO3-
(4)室温下,向盛一定量的稀氨水烧杯中逐滴加入物质的量浓度相同的醋酸,当恰好中和时,溶液的pH等于7(填“大于”、“等于”或“小于”).
(5)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲﹕c(OH-)乙小于10(填“大于”、“等于”或“小于”).
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |
(1)CH3COO-、CN-、CO32-结合质子(即H+)的能力大小顺序CO32->CN->CH3COO-;25℃时,有等浓度的①CH3COONa溶液、②NaCN溶液、③NaHCO3溶液,三种溶液的pH由大到小的顺序为②>③>① (填序号).
(2)Na2CO3水溶液呈碱性的原因,用离子方程式表示:CO32-+H2O?HCO3-+OH-,溶液中各离子浓度大小顺序:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
(3)NaCN溶液中通入少量二氧化碳,反应的离子方程式为CO2+CN-+H2O=HCN+HCO3-
(4)室温下,向盛一定量的稀氨水烧杯中逐滴加入物质的量浓度相同的醋酸,当恰好中和时,溶液的pH等于7(填“大于”、“等于”或“小于”).
(5)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲﹕c(OH-)乙小于10(填“大于”、“等于”或“小于”).
 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
 的名称1,2-二甲苯(或邻二甲苯),D的核磁共振氢谱有3组峰,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),D的核磁共振氢谱有3组峰,DMP的分子式为C10H10O4.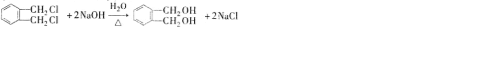 .
.