题目内容
7.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,
(3)写出⑤的最高价氧化物跟⑨的最高价氧化物的水化物在水溶液中反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)写出②最低价氢化物跟它的氧化物的水化物形成的所有化合物的化学式NH4NO3、NH4NO2,该化合物中含有的化学键有离子键和共价键.
分析 由元素在周期表中的位置可知,①为C,②为N,③为O,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,然后结合元素的单质及化合物的性质、化学用语等来解答.
解答 解:由元素在周期表中的位置可知,①为C,②为N,③为O,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,
(1)在这些元素中,化学性质最稳定的是稀有气体Ar,故答案为:Ar;
(2)元素的非金属性越强,其对应的最高价氧化物的水化物的酸性越强,由于F元素无正价,则最高价氧化物的水化物的酸性最强的化合物应是HClO4,
故答案为:HClO4;
(3)最高价氧化物是两性氧化物的元素是Al,其氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,离子方程式为Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)②最低价氢化物跟它的氧化物的水化物形成的所有化合物有NH4NO3、NH4NO2,为离子化合物,含有离子键和共价键,
故答案为:NH4NO3、NH4NO2;离子键和共价键.
点评 本题考查元素周期表和元素周期律,为高频考点,侧重于学生的分析能力的考查,明确元素的位置推断出各元素是解答的关键,熟悉元素及单质、化合物的性质即可解答,注意化学用语的应用,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
17. 如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
 如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | K2SO3粉末 | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3粉末 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
18.现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗.有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液.试回答以下问题.
(1)做酸碱中和滴定时,还缺少的试剂是蒸馏水和指示剂
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间.褪色所需时间tA<tB(填“>”、“=”或“<”).写出该反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol•L-1KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液紫红色并没有马上退去.将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪色了,可能原因是反应中生成的Mn2+有催化作用;当滴入最后一滴溶液,由无色变为浅紫色,且半分钟内不褪色,说明达到滴定终点.
③计算:重复上述操作2次,记录实验数据如下表.则消耗KMnO4溶液的平均体积为20.00mL,此样品的纯度为90.00%.(已知H2C2O4的相对分子质量为90)
④误差分析:下列操作会导致测定结果偏高的是AC.
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视.
(1)做酸碱中和滴定时,还缺少的试剂是蒸馏水和指示剂
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间.褪色所需时间tA<tB(填“>”、“=”或“<”).写出该反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol•L-1KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液紫红色并没有马上退去.将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪色了,可能原因是反应中生成的Mn2+有催化作用;当滴入最后一滴溶液,由无色变为浅紫色,且半分钟内不褪色,说明达到滴定终点.
③计算:重复上述操作2次,记录实验数据如下表.则消耗KMnO4溶液的平均体积为20.00mL,此样品的纯度为90.00%.(已知H2C2O4的相对分子质量为90)
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视.
15.下列关于太阳能、生物质能、氢能的说法不正确的是( )
| A. | 太阳能是地球上最基本的能源,绿色植物通过光合作用将太阳能转化成化学能 | |
| B. | 农业上的秸秆、枝叶、水生植物、动物粪便及城市和工业的有机废弃物都蕴藏着丰富的生物质能 | |
| C. | 生活垃圾送入焚烧炉产生的热量可发电、供暖,焚烧炉产生的气体可直接排放 | |
| D. | 氢能是理想的清洁能源,但氢气的水制备氢气的能耗、贮存、运输等一直阻碍着人们大量利用氢能的步伐;贮氢合金的发现和利用,开辟了解决氢气贮存、运输难题的新途径 |
2.下列说法或表示方法正确的是( )
| A. | 醛基的电子式: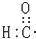 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 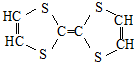 属于有机物 属于有机物 | D. | 聚丙烯的化学式: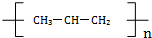 |
12.某原电池总反应的离子方程式为:2Fe3++Fe═3Fe2+,能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为FeSO4溶液 | |
| C. | 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Cu,电解质溶液为CuSO4溶液 |
19.下列属于同位素的一组是( )
| A. | 金刚石、石墨 | B. | H、D、T | C. | 1940K、2040Ca | D. | O2、O3 |
16.下列选项的括号内是除去杂质所用的试剂,其中错误的是( )
| A. | 氢气中混有二氧化硫(氢氧化钠溶液) | |
| B. | 硫酸亚铁溶液中含有硫酸铜(锌粉) | |
| C. | 二氧化硅中混有石灰石粉末(盐酸) | |
| D. | 二氧化碳中混有二氧化硫(小苏打溶液) |
17.下列各组物质中,互为同位素的是( )
| A. | 氕和氘 | B. | 水(H2O)和重水(D2O) | C. | 氧气和臭氧 | D. | 丁烷和异丁烷 |