题目内容
17.某粒子用ZARn+表示,下列关于该粒子的叙述中,正确的是( )| A. | 所含的质子数=A-n | B. | 所含电子数=Z+n | ||
| C. | 所含的中子数=A-Z | D. | 质量数=Z+A |
分析 根据元素符号的左下角表示质子数,左上角表示质量数,右上角表示所带电荷数,以及中子数=质量数-质子数,核电荷数=质子数=原子序数,阳离子中核外电子数=质子数-电荷数,原子中核外电子数=质子数来解答.
解答 解:AZRn+中质子数为Z,质量数为A,电荷数为n,中子数=质量数-质子数=A-Z,该微粒是阳离子,所以核外电子数=质子数-电荷数=Z-n,原子中核外电子数为Z,
A.所含的质子数为Z,故A错误;
B.所含的电子数为Z-n,故B错误;
C.所含的中子数为A-Z,故C正确;
D.该粒子质量数为A,故D错误;
故选C.
点评 本题考查了质子数、质量数、中子数、核外电子数之间的关系,难度不大,明确各物理量之间的关系是解本题的关键.

练习册系列答案
相关题目
7.下列各组混合物中,不能互溶的是( )
| A. | 乙醇和碘水 | B. | 乙醇和乙酸 | C. | 甲醛和水 | D. | 苯和水 |
8.运用元素周期律分析下面的推断正确的是( )
| A. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| B. | 砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 | |
| C. | 碳酸铯受热易分解 | |
| D. | 硒化氢是无色、有毒、比硫化氢稳定的气体 |
12.某原电池总反应的离子方程式为:2Fe3++Fe═3Fe2+,能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为FeSO4溶液 | |
| C. | 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Cu,电解质溶液为CuSO4溶液 |
2.在一个密闭容器中盛有N2和H2,它们的起始浓度分别是1.8mol/L和5.4mol/L,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8mol/L,则在这10min内NH3的平均反应速率是( )
| A. | 0.1 mol/(L•min) | B. | 0.2 mol/(L•min) | C. | 0.3 mol/(L•min) | D. | 0.6 mol/(L•min) |
9.A、B、C、D、E是元素周期表中前四周期中五种常见元素,原子序数逐渐增大.相关信息如下表:
请回答下列问题:
(1)A在元素周期表中的位置第二周期第ⅣA族;E的基态原子核外电子排布式是1s22s22p63s23p63d64s2
(2)B、C、D的简单离子半径由大到小的顺序为(用元素符号表示)S2->O2->Al3+,A、B、D的气态氢化物是最稳定的是H2O (写分子式).
(3)A与C形成的化合物中,A为最低价.该化合物下盐酸反应的化学方程式为Al4C3+12HCl═4AlCl3+3CH4.
(4)处理含AO、DO2烟道气污染的一种方法是将其在催化剂作用下转化为单质D.
已知:2AO(g)+O2(g)=2AO2(g)△H=-566.0kJ•mol-1
D(s)+O2(g)=DO2(g)△H=-296.0kJ•mol-1
此反应的热化学方程式是2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
| 元素 | 相关信息 |
| A | 基态原子核外三个能级有电子,且每个能级上电子数目相同 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 单质为常见金属,离子半径在同周期中最小 |
| D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E | 有多种化合价,有一种氧化物为黑色磁性晶体 |
(1)A在元素周期表中的位置第二周期第ⅣA族;E的基态原子核外电子排布式是1s22s22p63s23p63d64s2
(2)B、C、D的简单离子半径由大到小的顺序为(用元素符号表示)S2->O2->Al3+,A、B、D的气态氢化物是最稳定的是H2O (写分子式).
(3)A与C形成的化合物中,A为最低价.该化合物下盐酸反应的化学方程式为Al4C3+12HCl═4AlCl3+3CH4.
(4)处理含AO、DO2烟道气污染的一种方法是将其在催化剂作用下转化为单质D.
已知:2AO(g)+O2(g)=2AO2(g)△H=-566.0kJ•mol-1
D(s)+O2(g)=DO2(g)△H=-296.0kJ•mol-1
此反应的热化学方程式是2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
6.如表是元素周期表的一部分(注意:以下各空所涉及的元素填元素符号,不能用字母代替).
(1)写出元素符号:CAl、ECl;
(2)C的离子的结构示意图 ;
;
(3)用电子式表示AD2的形成过程 ;
;
(4)A-H八种元素中(填元素符号或化学式)
①原子半径最大的元素是K;单质的氧化性最强的元素是F;
②酸性最强的最高价氧化物对应水化物是HClO4;碱性最强的最高价氧化物对应水化物是KOH.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |
(2)C的离子的结构示意图
 ;
;(3)用电子式表示AD2的形成过程
 ;
;(4)A-H八种元素中(填元素符号或化学式)
①原子半径最大的元素是K;单质的氧化性最强的元素是F;
②酸性最强的最高价氧化物对应水化物是HClO4;碱性最强的最高价氧化物对应水化物是KOH.
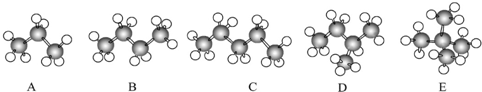
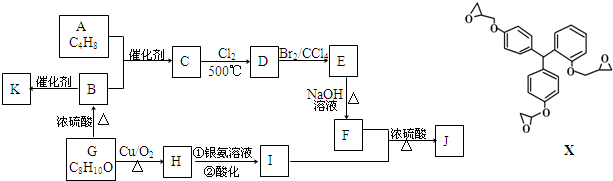
 .
.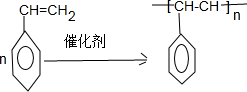 ;F+I→J
;F+I→J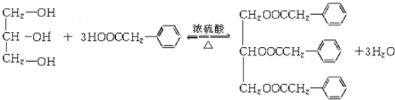 .
. (其中三种).
(其中三种).