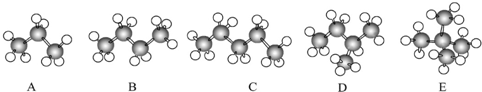
题目内容
20.有机物原子的共线及共面问题比较重要.在 分子中,可能处于同一平面上的原子数最多为( )
分子中,可能处于同一平面上的原子数最多为( )| A. | 12个 | B. | 22个 | C. | 16个 | D. | 20个 |
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断.注意单键可以旋转.
解答 解: 该有机物中含有苯环、碳碳双键、碳碳三键、甲基,甲基中C原子处于苯中H原子的位置,甲基通过旋转碳碳单键会有1个H原子处在苯环平面内,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子(苯环上6个、甲基中2个、碳碳双键上2个、碳碳三键上2个)共面.在甲基上可能还有1个氢原子共平面,则两个甲基有2个氢原子可能共平面,苯环上4个氢原子共平面,双键上2个氢原子共平面,总计得到可能共平面的原子有20个,故选D.
该有机物中含有苯环、碳碳双键、碳碳三键、甲基,甲基中C原子处于苯中H原子的位置,甲基通过旋转碳碳单键会有1个H原子处在苯环平面内,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子(苯环上6个、甲基中2个、碳碳双键上2个、碳碳三键上2个)共面.在甲基上可能还有1个氢原子共平面,则两个甲基有2个氢原子可能共平面,苯环上4个氢原子共平面,双键上2个氢原子共平面,总计得到可能共平面的原子有20个,故选D.
点评 本题主要考查有机物结构中共面、共线问题,难度中等,关键是空间想象,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,单键可以旋转.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
10.下列各轨道能量由低到高排列的是( )
| A. | 1s 2p 3s 3d | B. | 2s 2px 2py 2pz | C. | 1s 3s 3d 4s | D. | 4f 3p 2p 1s |
11.近来,科学家研制了一种新型的乙醇电池,它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O2→2CO2+3H2O.下列说法不正确的是( )
| A. | C2H5OH在电池的负极上参加反应 | |
| B. | 在外电路中电子由负极沿导线流向正极 | |
| C. | 1mol乙醇被氧化转移6mol电子 | |
| D. | 电解质溶液中阳离子移向正极,阴离子移向负极 |
8.运用元素周期律分析下面的推断正确的是( )
| A. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| B. | 砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 | |
| C. | 碳酸铯受热易分解 | |
| D. | 硒化氢是无色、有毒、比硫化氢稳定的气体 |
15.下列关于太阳能、生物质能、氢能的说法不正确的是( )
| A. | 太阳能是地球上最基本的能源,绿色植物通过光合作用将太阳能转化成化学能 | |
| B. | 农业上的秸秆、枝叶、水生植物、动物粪便及城市和工业的有机废弃物都蕴藏着丰富的生物质能 | |
| C. | 生活垃圾送入焚烧炉产生的热量可发电、供暖,焚烧炉产生的气体可直接排放 | |
| D. | 氢能是理想的清洁能源,但氢气的水制备氢气的能耗、贮存、运输等一直阻碍着人们大量利用氢能的步伐;贮氢合金的发现和利用,开辟了解决氢气贮存、运输难题的新途径 |
12.某原电池总反应的离子方程式为:2Fe3++Fe═3Fe2+,能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为FeSO4溶液 | |
| C. | 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Cu,电解质溶液为CuSO4溶液 |
9.A、B、C、D、E是元素周期表中前四周期中五种常见元素,原子序数逐渐增大.相关信息如下表:
请回答下列问题:
(1)A在元素周期表中的位置第二周期第ⅣA族;E的基态原子核外电子排布式是1s22s22p63s23p63d64s2
(2)B、C、D的简单离子半径由大到小的顺序为(用元素符号表示)S2->O2->Al3+,A、B、D的气态氢化物是最稳定的是H2O (写分子式).
(3)A与C形成的化合物中,A为最低价.该化合物下盐酸反应的化学方程式为Al4C3+12HCl═4AlCl3+3CH4.
(4)处理含AO、DO2烟道气污染的一种方法是将其在催化剂作用下转化为单质D.
已知:2AO(g)+O2(g)=2AO2(g)△H=-566.0kJ•mol-1
D(s)+O2(g)=DO2(g)△H=-296.0kJ•mol-1
此反应的热化学方程式是2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
| 元素 | 相关信息 |
| A | 基态原子核外三个能级有电子,且每个能级上电子数目相同 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 单质为常见金属,离子半径在同周期中最小 |
| D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E | 有多种化合价,有一种氧化物为黑色磁性晶体 |
(1)A在元素周期表中的位置第二周期第ⅣA族;E的基态原子核外电子排布式是1s22s22p63s23p63d64s2
(2)B、C、D的简单离子半径由大到小的顺序为(用元素符号表示)S2->O2->Al3+,A、B、D的气态氢化物是最稳定的是H2O (写分子式).
(3)A与C形成的化合物中,A为最低价.该化合物下盐酸反应的化学方程式为Al4C3+12HCl═4AlCl3+3CH4.
(4)处理含AO、DO2烟道气污染的一种方法是将其在催化剂作用下转化为单质D.
已知:2AO(g)+O2(g)=2AO2(g)△H=-566.0kJ•mol-1
D(s)+O2(g)=DO2(g)△H=-296.0kJ•mol-1
此反应的热化学方程式是2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
10.下列实验的设计可行的是( )
| A. | 用澄清石灰水可区别Na2CO3和NaHCO3粉末 | |
| B. |  用如图装置进行浓硝酸与铜的反应制取并收集NO2 用如图装置进行浓硝酸与铜的反应制取并收集NO2 | |
| C. | 检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸 | |
| D. | 除去粗盐中的Ca2+、Mg2+、SO42-,可依次加入H2O、NaOH、BaCl2、Na2CO3,过滤再加入HCl |