题目内容
10.下列说法不正确的是( )| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
分析 A.甲苯可被酸性高锰酸钾氧化;
B.苯酚与氯化铁发生显色反应;
C.卤代烃为非电解质,不能电离出离子;
D.植物油含有碳碳双键,可发生加成反应.
解答 解:A.苯与酸性高锰酸钾不反应,甲苯可被酸性高锰酸钾氧化,可鉴别,故A正确;
B.苯酚与氯化铁发生显色反应,甘油不反应,可鉴别,故B正确;
C.卤代烃为非电解质,不能电离出离子,应水解后鉴别,故C错误;
D.植物油含有碳碳双键,可发生加成反应,能使溴的四氯化碳溶液褪色的为植物油,故D正确.
故选C.
点评 本题考查有机物的鉴别,为高频考点,侧重于学生的分析、实验能力的考查,注意把握有机物的性质的异同以及官能团的性质,难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
1.聚合硫酸铁(PFS)是一种重要的无机高分子絮凝剂,在工业和生活污水处理等领域具有重要应用.PFS可表示成Fex(OH)y(SO4)z(其中铁元素化合价为+3),工业上常用绿矾等原料制备,采用“一锅法”制备PFS的工艺流程如下.
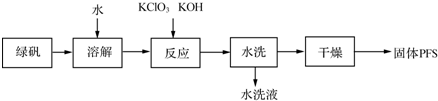
(1)从上述流程判断,水洗液中可以回收的主要物质有KCl、K2SO4.
(2)绿矾溶液与KClO3、KOH发生反应,其中还原剂与氧化剂的物质的量之比为6:1.
(3)下表是PFS的三种生产工艺所使用的原料.
试分析“一锅法”工艺的优点是未使用硫酸,不腐蚀设备,选择表中的一种方案分析其可能的缺点双氧水法:反应放热,双氧水分解(或次氯酸钠法:产生氯气,污染环境或硝酸氧化法:产生NO2等氮氧化物污染环境).
(4)在PFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=$\frac{n(O{H}^{-})}{3n(Fe)}$×100%,式中n(OH-)、n(Fe)分别表示聚合硫酸铁中OH-和Fe的物质的量.取7.51g某聚合硫酸铁溶解于稀盐酸,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g;再向上述滤液中加入足量NH3•H2O,经过滤、洗涤、干燥、灼烧得Fe2O3固体2.80g.试计算该固体聚合硫酸铁的盐基度.

(1)从上述流程判断,水洗液中可以回收的主要物质有KCl、K2SO4.
(2)绿矾溶液与KClO3、KOH发生反应,其中还原剂与氧化剂的物质的量之比为6:1.
(3)下表是PFS的三种生产工艺所使用的原料.
| 方法 | 双氧水氧化法 | 次氯酸钠氧化法 | 硝酸氧化法 |
| 原料 | 绿矾、硫酸、双氧水 | 绿矾、硫酸、次氯酸钠 | 绿矾、硫酸、浓硝酸等 |
(4)在PFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=$\frac{n(O{H}^{-})}{3n(Fe)}$×100%,式中n(OH-)、n(Fe)分别表示聚合硫酸铁中OH-和Fe的物质的量.取7.51g某聚合硫酸铁溶解于稀盐酸,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g;再向上述滤液中加入足量NH3•H2O,经过滤、洗涤、干燥、灼烧得Fe2O3固体2.80g.试计算该固体聚合硫酸铁的盐基度.
18.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )


| A. | 形成产物C和D的化学键放出的总能量高于断开反应物A和B的化学键所吸收的总能量 | |
| B. | 该反应只有在加热条件下才能进行 | |
| C. | 反应物的总能量高于产物的总能量 | |
| D. | 该反应为吸热反应 |
15.下列说法不正确的是( )
| A. | 面粉增白剂中的成份CaO2具有强氧化性 | |
| B. | CaO能与SO2反应,可用作工业废气的脱硫剂 | |
| C. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| D. | PM2.5是指空气中直径≥2.5μm的颗粒物,它们分散在空气中形成胶体 |
19.常温下,实验室有0.01mol•L-1醋酸,下列叙述正确的是( )
| A. | c(CH3COO-)+c(OH-)=0.01 mol•L-1 | |
| B. | 与等体积pH=12的氨水混合后所得溶液显酸性 | |
| C. | 加入少量醋酸钠固体后所得溶液中c(CH3COO-)减小 | |
| D. | 与等体积0.01 mol•L-1NaNO3溶液混合后有:c(NO3-)=c(CH3COO-)+c(CH3COOH) |
20.下列化学用语正确的是( )
| A. | CH4分子的球棍模型: | B. | 硝基苯的结构简式: | ||
| C. | 苯的最简式 C6H6 | D. | 1-丁醇的键线式: |
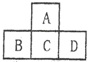 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答: ,.
,.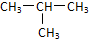
 A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.
A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.