题目内容
15.下列说法不正确的是( )| A. | 面粉增白剂中的成份CaO2具有强氧化性 | |
| B. | CaO能与SO2反应,可用作工业废气的脱硫剂 | |
| C. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| D. | PM2.5是指空气中直径≥2.5μm的颗粒物,它们分散在空气中形成胶体 |
分析 A.类比过氧化钠的化学性质进行判断过氧化钙具有的性质;
B.酸性氧化物能与碱性氧化物反应;
C.机动车尾气含有氮的氧化物能形成光化学烟雾;
D.根据三种常见分散系的分散质的直径大小,溶液小于1 nm,胶体为1-100 nm,浊液大于100 nm来判断.
解答 解:A.CaO2中的氧为-1价,类比过氧化钠的性质可知,过氧化钙化学性质比较活泼,具有强氧化性,故A正确;
B.酸性氧化物能与碱性氧化物反应,所以氧化钙能与二氧化硫反应,可用作工业废气的脱硫剂,故B正确;
C.机动车尾气含有氮的氧化物能形成光化学烟雾,新能源汽车的推广,减少了氮的氧化物,有助于减少光化学烟雾的产生,故C正确;
D.胶体的分散质的直径大小为1-100 nm,而PM2.5是指空气中直径≤2.5μm即2.5×10-6m的颗粒物,故形成的不是胶体,故D错误.
故选D.
点评 本题从增白剂、环境污染等角度考查了与生活密切相关的常识,较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.某溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Fe2+、Cl-、Br-、I-的个数比为5:4:3:4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为4:1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为( )
| A. | 6:1 | B. | 5:1 | C. | 7:1 | D. | 4:1 |
3.对于A2+3B2?2C的反应来说,以下化学反应速率的表示中,反应速度最快的是( )
| A. | v(B2)=0.8 mol/(L•s) | B. | v(B2)=3mol/(L•min) | C. | v(C)=0.6 mol/(L•s) | D. | v(A2)=0.4 mol/(L•s) |
10.下列说法不正确的是( )
| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
20.下列实验装置和操作能达到实验目的是( )
| A. |  除去CO2中的HCl气体 | B. |  吸收NH3 | ||
| C. |  灼烧海带灰 | D. |  乙醇和水的分离 |
7.下列依据相关实验得出的结论正确的是( )
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液在酒精灯火焰上进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
4.化学与社会生活密切相关,下列说法正确的是( )
| A. | 体积分数为95%的酒精通常作为医用酒精 | |
| B. | 石油的分馏、煤的气化、海水的提镁都包含化学变化 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能 |
5.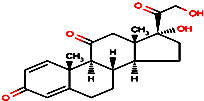 2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )
2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )
 2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )
2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )| A. | 分子式为C21H22O5 | |
| B. | 属于芳香族化合物 | |
| C. | 1mol该物质最多能与5molH2发生加成反应 | |
| D. | 该物质能发生加成、取代、氧化、水解等反应 |
 硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.
硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.