题目内容
5.下表是元素周期表的一部分,请根据此表回答:
(1)氟元素的原子核外电子数为9,第三周期(横行)的金属元素有3种.
(2)某元素的原子结构示意图为
 ,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6
,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6(3)原子序数为12的元素原子在化学反应中易失电子,形成的离子符号为Mg2+.
分析 (1)F元素是9号元素,原子核外电子数等于原子序数;第三周期的金属元素有Na、Mg、Al;
(2)周期数=电子层数、主族族序数=最外层电子数;
(3)原子序数为12的元素原子为Mg,属于金属元素,最外层电子数为2,易失去最外层2个电子形成阳离子.
解答 解:(1)F元素是9号元素,原子核外电子数等于原子序数,F原子核外电子数为9,第三周期的金属元素有Na、Mg、Al三种,故答案为:9;3;
(2)某元素的原子结构示意图为 ,原子核外有3个电子层,最外层电子数为6,处于第三周期VI族,为表中③的位置,故答案为:③;6;
,原子核外有3个电子层,最外层电子数为6,处于第三周期VI族,为表中③的位置,故答案为:③;6;
(3)原子序数为12的元素原子为Mg,属于金属元素,最外层电子数为2,易失去最外层2个电子形成Mg2+离子,故答案为:失;Mg2+.
点评 本题考查结构性质位置关系应用,比较基础,有利于基础知识的巩固.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
16.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝“确定为食品污染之一”而加以控制.铝在
下列场合须加以控制的是( )
①糖果内包装 ②电线电缆 ③牙膏皮 ④氢氧化铝胶囊(作内服药) ⑤用明矾和小苏打作出食物膨化剂.
下列场合须加以控制的是( )
①糖果内包装 ②电线电缆 ③牙膏皮 ④氢氧化铝胶囊(作内服药) ⑤用明矾和小苏打作出食物膨化剂.
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ②③⑤ | D. | 全部 |
10.能正确表示下列反应的离子方程式是( )
| A. | Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 等物质的量的MgCl2、Ba(OH)2和HC1溶液混合:Mg2++2OH-=Mg(OH)2↓ | |
| C. | 铜溶于稀硝酸中:Cu+4H++2NO${\;}_{3}^{-}$═Cu2++2NO2↑+2H2O | |
| D. | FeBr2溶液中通入少量的C12:2Fe2++C12=2Fe3++2C1- |
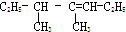 4,5-二甲基-3-庚烯
4,5-二甲基-3-庚烯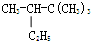 2,2,3一三甲基戊烷
2,2,3一三甲基戊烷