题目内容
20.取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
则KMnO4、H2O2、PbO2氧化性由强到弱的顺序为PbO2>KMnO4>H2O2.
分析 根据实验现象确定氧化剂,根据规律:氧化还原反应正中氧化剂的氧化性大于氧化产物的氧化性来回答.
解答 解:实验①说明H2O2能被KMnO4氧化,所以氧化性:KMnO4>H2O2;实验②说明Mn2+能与PbO2反应生成KMnO4,得出氧化性:PbO2>KMnO4,综上得出,氧化性顺序是:PbO2>KMnO4>H2O2,故答案为:PbO2>KMnO4>H2O2.
点评 本题考查学生氧化还原反应中,氧化性、还原性强弱的判断以及氧化还原方程式的书写等方面的知识,属于综合知识的考查,难度不大

练习册系列答案
相关题目
10.在下列反应中,HCl作还原剂的是( )
| A. | Al2O3+6HCl=2AlCl3+3H2O | |
| B. | 2Al+6HCl=2AlCl3+3H2↑ | |
| C. | Al(OH)3+3HCl=AlCl3+3H2O | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O |
11. 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )
实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )
①装有铜片的孔穴中溶液呈蓝色;②装有胆矾的孔穴中固体的颜色变浅;③装有铝片的孔穴中有红棕色气体生成;④装有蛋清溶液的孔穴中呈浅黄色.
 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )
实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )①装有铜片的孔穴中溶液呈蓝色;②装有胆矾的孔穴中固体的颜色变浅;③装有铝片的孔穴中有红棕色气体生成;④装有蛋清溶液的孔穴中呈浅黄色.
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①② |
8.不用外加试剂把下列溶液鉴别出来的先后顺序正确的是( )
①CuCl2
②NaNO3
③MgCl2
④NaOH.
①CuCl2
②NaNO3
③MgCl2
④NaOH.
| A. | ①②③④ | B. | ①③④② | C. | ④①②③ | D. | ①④③② |
15.下列有关物质检验的实验结论正确的是( )
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 取1mL20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,直接加入少量新制备的Cu(OH)2,加热3~5min,没有产生砖红色沉淀 | 说明蔗糖没有水解. |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
12.下列说法正确的是( )
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 要将溶解在CCl4中的碘单质分离出来,可以用蒸馏法,因为碘易升华,先分离出来 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
9.某无色溶液中存在大量NH${\;}_{4}^{+}$、H+、Cl-,还可能大量存在的离子是( )
| A. | CO${\;}_{3}^{2-}$ | B. | Al3+ | C. | Cu2+ | D. | OH- |
3.草酸合铁酸钾晶体Kx[Fe(C2O4)y]•3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程.
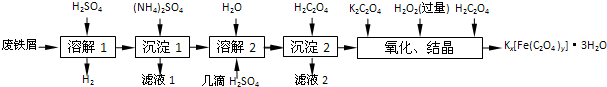
已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如下表:
(1)“溶解1”应保证铁屑稍过量,其目的是防止Fe2+被氧化为Fe3+.“溶解2”加“几滴H2SO4”的作用是抑制Fe2+水解.
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(3)“沉淀”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.

已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(3)“沉淀”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.

 ,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6
,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6