题目内容
8.FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
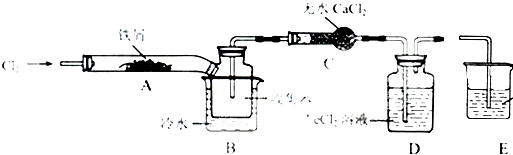
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端,要使沉积的FeCl3进入收集器,第④步操作是在沉积的FeCl3固体下方加热.
(3)装置B中冷水浴的作用为冷却,使FeCl3沉积,便于收集产品;装置C的名称为干燥管装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:KMnO4溶液.
(4)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤.
(5)尾气吸收装置E中所加试剂为氢氧化钠溶液.
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液.
(6)FeCl3与H2S反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+.
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为Fe2+-e-=Fe3+. 综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:①H2S的原子利用率为100%;②FeCl3可以循环利用.
分析 Ⅰ.装置A中铁与氯气反应,反应为:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;为防止外界空气中的水蒸气进入装置使FeCl3潮解,所以用装置C无水氯化钙来吸水,装置D中用FeCl2吸收Cl2时的反应离子方程式2Fe2++Cl2═2Fe3++2Cl-,用装置D中的副产品FeCl3溶液吸收H2S,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸,所以装置E为氢氧化钠溶液吸收氯气.
(1)装置A中铁与氯气反应生成氯化铁;
(2)要使沉积的FeCl3进入收集器,根据FeCl3加热易升华的性质;
(3)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;装置C的名称为干燥管;检验FeCl2是否失效应检验FeCl2是否存在,可以用KMnO4溶液检验;
(4)防止FeCl3潮解,不与水蒸气接触;
(5)尾气主要是氯气,可以用氢氧化钠溶液吸收,不用考虑防倒吸;
Ⅱ.(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应;
(7)根据实验Ⅱ的两个反应可知,FeCl3与H2S反应生成氯化亚铁,在电解池中氯化亚铁又被氧化成氯化铁,FeCl3可以循环利用,据此答题.
解答 解:Ⅰ.(1)氯气具有强氧化性,将变价铁氧化成高价铁,生成氯化铁,所以装置A中铁与氯气反应生成氯化铁,反应为2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,第④步操作是对FeCl3加热发生升华使沉积的FeCl3进入收集器,
故答案为:在沉积的FeCl3固体下方加热;
(3)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品,装置C的名称为干燥管,检验FeCl2是否失效,应检验FeCl2是否存在,可以用KMnO4溶液检验,
故答案为:冷却,使FeCl3沉积,便于收集产品;干燥管;KMnO4溶液;
(4)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2⑤用干燥的N2赶尽Cl2,故选:②⑤;
(5)尾气主要是氯气,可以用氢氧化钠溶液吸收,不用考虑防倒吸,故答案为:氢氧化钠溶液;
Ⅱ.(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应:2FeCl3+H2S=2FeCl2+2HCl+S↓,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;
(7)根据实验Ⅱ的两个反应可知,FeCl3与H2S反应生成氯化亚铁,在电解池中氯化亚铁又被氧化成氯化铁,FeCl3可以循环利用,所以该实验的优点是FeCl3可以循环利用,
故答案为:FeCl3可以循环利用.
点评 本题考查了制备无水FeCl3实验操作和实验设计,题目难度中等,侧重考查铁、氯、硫及其化合物的性质应用、实验基本操作的分析判断、实验现象的推断和应用,试题综合性较强,有利于培养学生灵活应用基础知识的能力.

| A. | “血液透析”利用了胶体的性质 | |
| B. | 竹炭具有超强的吸附能力,能吸附新装修房屋内的有害气体 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(3)“沉淀”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.
| A. | 硫的原子结构示意图: | |
| B. | NH4Cl的电子式: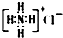 | |
| C. | 铝离子中的质子数和电子数之比为13:10 | |
| D. | 原子核内有30个中子的铁原子:2656Fe |

 ,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6
,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为5%物质的量浓度为0.28 mol/L.
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为5%物质的量浓度为0.28 mol/L.
 .
.