题目内容
16.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝“确定为食品污染之一”而加以控制.铝在下列场合须加以控制的是( )
①糖果内包装 ②电线电缆 ③牙膏皮 ④氢氧化铝胶囊(作内服药) ⑤用明矾和小苏打作出食物膨化剂.
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ②③⑤ | D. | 全部 |
分析 凡与人的食用物品及口腔接触的物品都必须控制铝的使用,使用铝制品包装食品、制炊具制成易拉罐可能对人体有危害,用含有铝的物质净化水或制药物或制食品蓬松剂对人体有危害.据此分析判断即可.
解答 解:②电线电缆与人的消化系统不直接接触,铝不会因使用进入人体,与人体健康无关,无需控制;
①糖果内包装 ②电线电缆 ③牙膏皮 ④氢氧化铝胶囊(作内服药) ⑤用明矾和小苏打作出食物膨化剂其中的铝元素能通过消化系统进入人体,需要加以控制.
故选:A.
点评 本题考查了铝的性质和用途,解答本题要掌握铝可能进入人体的途径,例如铝可以通过饮食、药物等途径进入人体从而危害人体健康,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
7.下列有机物命名正确的是( )
| A. |  2-甲基-3-丁炔 2-甲基-3-丁炔 | B. | 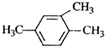 1,3,4-三甲苯 | C. | 2-甲基-1-丁炔 | D. | 2-乙基-1-丁烯 |
4.2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
资料:氰化钠化学式为NaCN,白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味.剧毒,皮肤伤口接触、吸入、吞食微量可中毒死亡.熔点563.7℃,沸点1496℃.易溶于水,易水解生成氰化氢,水溶液呈强碱性,是一种重要的化工原料,用于电镀、冶金和有机合成医药、农药及金属处理方面.
(1)用离子方程式表示其水溶液呈强碱性的原因:CN-+H2O?HCN+OH-.
(2)氰化钠要用双氧水或硫代硫酸钠中和.
①用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式NaCN+H2O2+H2O=NaHCO3+NH3↑;
②用硫代硫酸钠中和的离子方程式为CN-+S2O32-→A+SO32-,A为SCN-(填化学式).
(3)含氰废水中的CN-有剧毒.
①CN-中C元素显+2价,N元素显-3价,则非金属性N>C(填<,=或>)
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3.
(4)K2FeO4能非常充分的去除救援产生的废水(以下简称救援废水)中的CN-离子.根据K2FeO4加入的量,分别发生下列反应:
Ⅰ.3CN-+2FeO42-+5H2O¾→2Fe(OH)3+3CNO-+4OH-
Ⅱ.6CN-+10FeO42-+22H2O¾→10Fe(OH)3+6CO32-+3N2+14OH-
Ⅲ.3CN-+8FeO42-+17H2O¾→8Fe(OH)3+3CO32-+3NO2-+10OH-
Ⅳ.3CN-+10FeO42-+22H2O¾→10Fe(OH)3+3CO32-+3NO3-+14OH-
现取含CN-离子的救援废水,加入一定量的K2FeO4,控制溶液pH=11.2,反应10min后,CN-离子的去除率超过99%.(假定K2FeO4只与CN-反应)
实验①中,CN-被FeO42-氧化生成CNO-.
(5)室温下,0.1mol/L的氯化铵溶液和0.1mol/L的硫酸氢铵溶液,酸性更强的是NH4HSO4,
其原因是HSO4-有较大程度的电离,使溶液呈较强酸性.而NH4Cl只是NH4+水解呈弱酸性.已知:H2SO4:Ki2=1.2×10-2NH3•H2O:Ki=1.8×10-5.
资料:氰化钠化学式为NaCN,白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味.剧毒,皮肤伤口接触、吸入、吞食微量可中毒死亡.熔点563.7℃,沸点1496℃.易溶于水,易水解生成氰化氢,水溶液呈强碱性,是一种重要的化工原料,用于电镀、冶金和有机合成医药、农药及金属处理方面.
(1)用离子方程式表示其水溶液呈强碱性的原因:CN-+H2O?HCN+OH-.
(2)氰化钠要用双氧水或硫代硫酸钠中和.
①用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式NaCN+H2O2+H2O=NaHCO3+NH3↑;
②用硫代硫酸钠中和的离子方程式为CN-+S2O32-→A+SO32-,A为SCN-(填化学式).
(3)含氰废水中的CN-有剧毒.
①CN-中C元素显+2价,N元素显-3价,则非金属性N>C(填<,=或>)
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3.
(4)K2FeO4能非常充分的去除救援产生的废水(以下简称救援废水)中的CN-离子.根据K2FeO4加入的量,分别发生下列反应:
Ⅰ.3CN-+2FeO42-+5H2O¾→2Fe(OH)3+3CNO-+4OH-
Ⅱ.6CN-+10FeO42-+22H2O¾→10Fe(OH)3+6CO32-+3N2+14OH-
Ⅲ.3CN-+8FeO42-+17H2O¾→8Fe(OH)3+3CO32-+3NO2-+10OH-
Ⅳ.3CN-+10FeO42-+22H2O¾→10Fe(OH)3+3CO32-+3NO3-+14OH-
现取含CN-离子的救援废水,加入一定量的K2FeO4,控制溶液pH=11.2,反应10min后,CN-离子的去除率超过99%.(假定K2FeO4只与CN-反应)
| 实验 | CN- 浓度 | 加入救援废水中的K2FeO4 | ||
| 救援废水 | 残余 | 浓度 | 利用率 | |
| ① | 10mg/L | 0.082mg/L | 75mg/L | 67.14% |
(5)室温下,0.1mol/L的氯化铵溶液和0.1mol/L的硫酸氢铵溶液,酸性更强的是NH4HSO4,
其原因是HSO4-有较大程度的电离,使溶液呈较强酸性.而NH4Cl只是NH4+水解呈弱酸性.已知:H2SO4:Ki2=1.2×10-2NH3•H2O:Ki=1.8×10-5.
11. 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )
实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )
①装有铜片的孔穴中溶液呈蓝色;②装有胆矾的孔穴中固体的颜色变浅;③装有铝片的孔穴中有红棕色气体生成;④装有蛋清溶液的孔穴中呈浅黄色.
 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )
实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )①装有铜片的孔穴中溶液呈蓝色;②装有胆矾的孔穴中固体的颜色变浅;③装有铝片的孔穴中有红棕色气体生成;④装有蛋清溶液的孔穴中呈浅黄色.
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①② |
1.下列物质的使用不涉及化学变化的是( )
| A. | 明矾用作净水剂 | B. | 铝镁合金材料制造飞机 | ||
| C. | 常温下,铁槽车运输浓硝酸 | D. | 用铝热反应焊接钢轨 |
8.不用外加试剂把下列溶液鉴别出来的先后顺序正确的是( )
①CuCl2
②NaNO3
③MgCl2
④NaOH.
①CuCl2
②NaNO3
③MgCl2
④NaOH.
| A. | ①②③④ | B. | ①③④② | C. | ④①②③ | D. | ①④③② |

 ,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6
,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为5%物质的量浓度为0.28 mol/L.
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为5%物质的量浓度为0.28 mol/L.