题目内容
4.下列说法中,错误的是( )| A. | 原子间通过共用电子形成的化学键叫共价键 | |
| B. | 对双原子分子来说,键能越大,断开时需要的能量越多,该化学键越不牢固 | |
| C. | 一般而言,化学键的键长越短,键越牢固,分子越稳定 | |
| D. | 成键原子间原子轨道重叠得越多,共价键越牢固 |
分析 A.共价键为原子之间的静电作用力;
B.键能越大,越稳定;
C.化学键的键长越短,分子越稳定;
D.原子轨道重叠得越多,键长越短,分子越稳定.
解答 解:A.非金属元素的原子间通过共用电子形成的化学键叫共价键,故A正确;
B.对双原子分子来说,键能越大,断开时需要的能量越多,该化学键越牢固,故B错误;
C.一般而言,化学键的键长越短,键越牢固,断开时需要的能量越多,分子越稳定,故C正确;
D.共价键的重叠程度与共价键的稳定性有关,则成键原子间原子轨道重叠得越多,共价键越牢固,故D正确;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意共价键的形成及类型,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
15.某元素由2种同位素组成,其原子比为5:2,第一种同位素的二价阳离子有27个电子,34个中子;第二种同位素原子的中子数比第一种多2个,该元素的平均近似相对原子质量为( )
| A. | 63.47 | B. | 64.47 | C. | 63.57 | D. | 64.57 |
12.下列分子中各原子都满足8e-结构的是( )
| A. | SO2 | B. | CH4 | C. | PCl3 | D. | PCl5 |
19.下列关于①苯②乙醇③乙酸④葡萄糖等有机物的叙述中,不正确的是( )
| A. | 可以用新制氢氧化铜鉴别③与④ | B. | ①、②、③均能与金属钠反应 | ||
| C. | ①、②、③均能发生取代反应 | D. | 一定条件下,④可以转化为② |
9.下表列出前20号元素中的某些元素性质的一些数据:
试回答下列问题:
(1)写出E基态原子的价电子排布式2s2sp2
(2)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是CCl4(写出分子式,一个即可).
(3)元素E与氢元素可形成一种相对分子质量为28的分子,其分子中E元素原子以sp2(填杂化方式)杂化成键,分子中共形成5个σ键,1个π键.
(4)C和I相比较,非金属性较强的是氧(填元素名称),可以验证你的结论的是下列中的AC(填编号).
A.气态氢化物的稳定性 B.两单质在自然界的存在
C.两元素的电负性 D.含氧酸的酸性
(5)I的第一电离能大于C的第一电离能(填“大于”或“小于”),原因是N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,失去电子需要的能量较高.
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)写出E基态原子的价电子排布式2s2sp2
(2)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是CCl4(写出分子式,一个即可).
(3)元素E与氢元素可形成一种相对分子质量为28的分子,其分子中E元素原子以sp2(填杂化方式)杂化成键,分子中共形成5个σ键,1个π键.
(4)C和I相比较,非金属性较强的是氧(填元素名称),可以验证你的结论的是下列中的AC(填编号).
A.气态氢化物的稳定性 B.两单质在自然界的存在
C.两元素的电负性 D.含氧酸的酸性
(5)I的第一电离能大于C的第一电离能(填“大于”或“小于”),原因是N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,失去电子需要的能量较高.
16.下列说法正确的是( )
| A. | 乙烯和聚乙烯都能与水发生加成反应 | |
| B. | 实验室制溴苯时选用的试剂可以是溴水、苯和铁屑 | |
| C. | 配制银氨溶液时,将氨水逐滴加到 AgNO3溶液中,边加边振荡,直至沉淀恰好完全消失 | |
| D. | 银镜反应实验后试管内壁附有银,可用稀硫酸清洗 |
13.下列说法正确的是( )
| A. | 汽油和花生油都可发生皂化反应 | |
| B. | 蚕丝、棉、麻、的主要成分都是纤维素 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 加热马铃薯可使其中的淀粉变成葡萄糖 |
14.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 | 0.075 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 | -3 |
| A. | T的氢化物水溶液呈酸性 | |
| B. | L、M的单质与稀盐酸反应速率:M>L | |
| C. | R的氢化物H2R分子中有10个电子 | |
| D. | L、Q形成的简单离子核外电子数相等 |
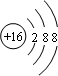 ,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为:
,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为: .AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.
.AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.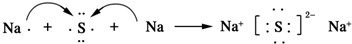 .该化合物属于离子(填“共价”或“离子”)化合物.
.该化合物属于离子(填“共价”或“离子”)化合物.