题目内容
16.下列说法正确的是( )| A. | 乙烯和聚乙烯都能与水发生加成反应 | |
| B. | 实验室制溴苯时选用的试剂可以是溴水、苯和铁屑 | |
| C. | 配制银氨溶液时,将氨水逐滴加到 AgNO3溶液中,边加边振荡,直至沉淀恰好完全消失 | |
| D. | 银镜反应实验后试管内壁附有银,可用稀硫酸清洗 |
分析 A.聚乙烯中不含碳碳双键;
B.溴水、苯不反应;
C.制备银氨溶液时,向硝酸银溶液中滴加氨水;
D.Ag与稀硫酸不反应.
解答 解:A.聚乙烯中不含碳碳双键,与水不反应,而乙烯与水发生加成反应,故A错误;
B.实验室制溴苯时选用的试剂可以是液溴、苯和铁屑,故B错误;
C.制备银氨溶液时,向硝酸银溶液中滴加氨水,即操作为将氨水逐滴加到 AgNO3溶液中,边加边振荡,当沉淀恰好完全消失为银氨溶液,故C正确;
D.Ag与稀硫酸不反应,则银镜反应实验后试管内壁附有银,可用稀硝酸清洗,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的性质、有机物制备、银氨溶液制备、仪器洗涤等,把握反应原理及物质的性质为解答的关键,侧重分析与实验能力的考查,注意选项B解答的易错点,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
6.同温同压下,下列各反应均为放热反应,则各热化学方程式中Q数值最小的是( )
| A. | 2A(l)+B(l)=2C(g)△H1=-Q1 | B. | 2A(g)+B(g)=2C(g)△H2=-Q2 | ||
| C. | 2A(g)+B(g)=2C(l)△H3=-Q3 | D. | 2A(l)+B(l)=2C(l)△H4=-Q4 |
7.元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质与水剧烈反应产生氧气.则下列判断不正确的是( )
| R | ||
| X | T | Z |
| Q |
| A. | 非金属性:X<T<Z | B. | R和Q的电子数差为26 | ||
| C. | 气态氢化物稳定性:R<T<Z | D. | 最高价含氧酸酸性:T>Q |
4.下列说法中,错误的是( )
| A. | 原子间通过共用电子形成的化学键叫共价键 | |
| B. | 对双原子分子来说,键能越大,断开时需要的能量越多,该化学键越不牢固 | |
| C. | 一般而言,化学键的键长越短,键越牢固,分子越稳定 | |
| D. | 成键原子间原子轨道重叠得越多,共价键越牢固 |
11.下列有机物分子在核磁共振氢谱中只给出一种信号的是( )
| A. | CH3COOCH3 | B. | HCHO | C. | HCOOH | D. | CH3OH |
1.下列反应的化学方程式或离子方程式表示正确的是( )
| A. | 1,3-丁二烯的1,2-加成:H2C=CHCH=CH2+Cl2→CH2ClCH=CHCH2Cl | |
| B. | 甲苯和氯气光照条件下发生反应: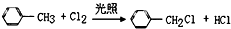 | |
| C. | 用醋酸去除水垢:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH4)2OH$\stackrel{水浴加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O |
8. 如图为化学教学中所用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
如图为化学教学中所用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
 如图为化学教学中所用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
如图为化学教学中所用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )| A. | CO2和NaOH溶液 | B. | O2和H2O | C. | NH3和H2O | D. | SO2和NaOH溶液 |
5.海水资源的利用具有广阔前景.海水中主要离子的含量如下:
利用海水可以提取溴和镁,提取过程如下:

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是对溴元素进行富集,吸收塔中发生反应的化学方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(2)Mg(OH)2中加盐酸的反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O.
(3)写出无水MgCl2得到Mg的化学方程式MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2溶解).
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是对溴元素进行富集,吸收塔中发生反应的化学方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(2)Mg(OH)2中加盐酸的反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O.
(3)写出无水MgCl2得到Mg的化学方程式MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2溶解).
6.将体积比1:4的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论叙述不正确的是( )
| A. | 产物中只有四氯化碳分子是正四面体结构 | |
| B. | 瓶中气体的黄绿色逐渐变浅,瓶内壁有油状液滴形成 | |
| C. | 若日光直射,可能发生爆炸 | |
| D. | 生成物只有CCl4、HCl |