题目内容
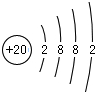
15.某元素由2种同位素组成,其原子比为5:2,第一种同位素的二价阳离子有27个电子,34个中子;第二种同位素原子的中子数比第一种多2个,该元素的平均近似相对原子质量为( )| A. | 63.47 | B. | 64.47 | C. | 63.57 | D. | 64.57 |
分析 第一种同位素的二价阳离子有27个电子,那么质子数=27+2=29,那么质量数为29+34=63,第二种元素的质量数=29+34+2=65,据此解答即可.
解答 解:第一种同位素的二价阳离子有27个电子,那么质子数=27+2=29,那么质量数为29+34=63,第二种元素的质量数=29+34+2=65,那么此种元素的相对原子质量=$\frac{5×63+2×65}{5+2}$=63.57,故选C.
点评 本题主要考查的是元素质量数、质子数与中子数和相对原子质量的关系,质量数=质子数+中子数,难度不大.

练习册系列答案
相关题目
6.同温同压下,下列各反应均为放热反应,则各热化学方程式中Q数值最小的是( )
| A. | 2A(l)+B(l)=2C(g)△H1=-Q1 | B. | 2A(g)+B(g)=2C(g)△H2=-Q2 | ||
| C. | 2A(g)+B(g)=2C(l)△H3=-Q3 | D. | 2A(l)+B(l)=2C(l)△H4=-Q4 |
3.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)11种元素中,化学性质最不活泼的是Ar.
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH.
(3)②③④中形成的简单离子半径由大到小的顺序是K+>Ca2+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,该氢化物常温下和元素②的单质反应的离子方程式是2K+2H2O═2K++2OH-+H2↑,该氢化物与元素⑧的单质反应的离子方程式是Cl2+H2O═H++Cl-+HClO.
(5)①和⑨的最高价氧化物对应的水化物的化学式为NaOH和HBrO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-═2Cl-+Br2.
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3═NaAlO2+2H2O.
(7)⑥和⑧形成的化合物的化学式为CCl4,该化合物溶解⑨的单质所得溶液为溴的CCl4溶液.
(8)⑧⑨⑪三种元素形成的气态氢化物最稳定的是HF.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑪ | |||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH.
(3)②③④中形成的简单离子半径由大到小的顺序是K+>Ca2+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,该氢化物常温下和元素②的单质反应的离子方程式是2K+2H2O═2K++2OH-+H2↑,该氢化物与元素⑧的单质反应的离子方程式是Cl2+H2O═H++Cl-+HClO.
(5)①和⑨的最高价氧化物对应的水化物的化学式为NaOH和HBrO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-═2Cl-+Br2.
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3═NaAlO2+2H2O.
(7)⑥和⑧形成的化合物的化学式为CCl4,该化合物溶解⑨的单质所得溶液为溴的CCl4溶液.
(8)⑧⑨⑪三种元素形成的气态氢化物最稳定的是HF.
7.元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质与水剧烈反应产生氧气.则下列判断不正确的是( )
| R | ||
| X | T | Z |
| Q |
| A. | 非金属性:X<T<Z | B. | R和Q的电子数差为26 | ||
| C. | 气态氢化物稳定性:R<T<Z | D. | 最高价含氧酸酸性:T>Q |
4.下列说法中,错误的是( )
| A. | 原子间通过共用电子形成的化学键叫共价键 | |
| B. | 对双原子分子来说,键能越大,断开时需要的能量越多,该化学键越不牢固 | |
| C. | 一般而言,化学键的键长越短,键越牢固,分子越稳定 | |
| D. | 成键原子间原子轨道重叠得越多,共价键越牢固 |
5.海水资源的利用具有广阔前景.海水中主要离子的含量如下:
利用海水可以提取溴和镁,提取过程如下:

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是对溴元素进行富集,吸收塔中发生反应的化学方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(2)Mg(OH)2中加盐酸的反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O.
(3)写出无水MgCl2得到Mg的化学方程式MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2溶解).
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是对溴元素进行富集,吸收塔中发生反应的化学方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(2)Mg(OH)2中加盐酸的反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O.
(3)写出无水MgCl2得到Mg的化学方程式MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2溶解).

 ,写出气体甲的电子式
,写出气体甲的电子式 .
.