题目内容
9.下表列出前20号元素中的某些元素性质的一些数据:| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)写出E基态原子的价电子排布式2s2sp2
(2)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是CCl4(写出分子式,一个即可).
(3)元素E与氢元素可形成一种相对分子质量为28的分子,其分子中E元素原子以sp2(填杂化方式)杂化成键,分子中共形成5个σ键,1个π键.
(4)C和I相比较,非金属性较强的是氧(填元素名称),可以验证你的结论的是下列中的AC(填编号).
A.气态氢化物的稳定性 B.两单质在自然界的存在
C.两元素的电负性 D.含氧酸的酸性
(5)I的第一电离能大于C的第一电离能(填“大于”或“小于”),原因是N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,失去电子需要的能量较高.
分析 前20号元素中,AC都有最低价-2,处于VIA族,A有+6价,C只有-2价,则A为S元素、C为O元素;E、J都有+4、-4价,处于IVA族,E的原子半径较小,则E是C元素、J是Si;F、I都有+5、-3价,处于VA族,F的原子半径大于I,则F是P元素、I是N元素;G有+7、-1价,为ⅦA族元素,G是Cl元素;D只有+3价,为ⅢA族元素,原子半径大于Si原子半径,所以D是Al元素;B、H最高正价为+1,没有负价,处于IA族,B的原子半径比Al原子半径大很多,不能处于同周期,则B为K元素,B、H原子半径相差不是太大,应相邻,则H为Na,据此解答.
解答 解:前20号元素中,AC都有最低价-2,处于VIA族,A有+6价,C只有-2价,则A为S元素、C为O元素;E、J都有+4、-4价,处于IVA族,E的原子半径较小,则E是C元素、J是Si;F、I都有+5、-3价,处于VA族,F的原子半径大于I,则F是P元素、I是N元素;G有+7、-1价,为ⅦA族元素,G是Cl元素;D只有+3价,为ⅢA族元素,原子半径大于Si原子半径,所以D是Al元素;B、H最高正价为+1,没有负价,处于IA族,B的原子半径比Al原子半径大很多,不能处于同周期,则B为K元素,B、H原子半径相差不是太大,应相邻,则H为Na.
(1)E为碳元素,基态原子的价电子排布式为2s2sp2,故答案为:2s2sp2;
(2)C、P、Cl三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 CCl4、PCl3,故答案为:CCl4等;
(3)元素E(碳)与氢元素可形成一种相对分子质量为28的分子,该分子为CH2=CH2,为平面结构,其分子中碳元素原子以 sp2杂化成键,分子中共形成5个σ键,1个π键,
故答案为:sp2;5;1;
(4)C是O元素、I是N元素,为同周期元素,从左到右元素的非金属性逐渐增强,则非金属性O的较强;
A.非金属性越强,氢化物越稳定,故A正确;
B.两单质在自然界的存在,不能说明非金属强弱,故B错误;
C.电负性越大,对键合电子吸引力越大,元素非金属性越强,故C正确;
D.氧元素没有含氧酸,不能比较最高价含氧酸的酸性判断非金属性强弱,故D错误,
故答案为:氧;AC;
(5)同周期最原子序数增大,越大第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,失去电子需要的能量较高,故第一电离能高于O元素,
故答案为:大于;N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,失去电子需要的能量较高.
点评 本题考查位置结构性质关系应用,侧重对学生分析能力的考查,根据原子半径、化合价确定元素是解答关键,难度中等,注意理解同周期第一电离能异常情况.

 阅读快车系列答案
阅读快车系列答案 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )| A. | X分子式为C6H7O7 | |
| B. | 1 mol物质X可以和4mol氢氧化钠发生反应 | |
| C. | X分子内所有原子均在同一平面内 | |
| D. | 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
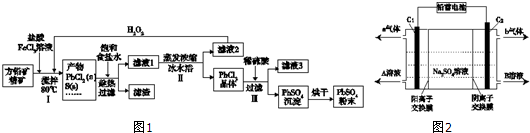
已知:(ⅰ)PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
| Ksp | 开始沉淀时pH | 完全沉淀时pH | ||
| PbSO4 | 1.08×10-8 | Fe (OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Pb( OH)2 | 6 | 7.04 |
(1)步骤Ⅰ中生成PbCl2的离子方程式PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓,加入盐酸控制pH值小于2,原因是抑制Fe3+、Pb2+的水解,防止生成Fe(OH)3、Pb(OH)2沉淀.
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出.若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是Fe3+水解生成Fe(OH)3胶体,吸附溶液中悬浮杂质,被共同沉淀.
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)=PbSO4(s)+2Cl-(aq).
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为PbSO4+2e-=Pb+SO42-.
(6)双隔膜电解池的结构示意简图如图2所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是AD
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑
| A. | 原子间通过共用电子形成的化学键叫共价键 | |
| B. | 对双原子分子来说,键能越大,断开时需要的能量越多,该化学键越不牢固 | |
| C. | 一般而言,化学键的键长越短,键越牢固,分子越稳定 | |
| D. | 成键原子间原子轨道重叠得越多,共价键越牢固 |
| A. | 其水溶液显弱酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 苯酚溶液不能使酸性高锰酸钾溶液褪色 |
| A. | 1,3-丁二烯的1,2-加成:H2C=CHCH=CH2+Cl2→CH2ClCH=CHCH2Cl | |
| B. | 甲苯和氯气光照条件下发生反应: | |
| C. | 用醋酸去除水垢:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH4)2OH$\stackrel{水浴加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O |
| A. | N、O、F的原子半径依次增大 | B. | H2O、NH3、PH3的热稳定性依次增强 | ||
| C. | HCl、HBr、HI的还原性依次减弱 | D. | LiOH、KOH、CsOH的碱性依次增强 |
| A. | 阿伏加德罗、汤姆生 | B. | 道尔顿、拉瓦锡 | ||
| C. | 舍勒、普利斯特里 | D. | 汤姆生、道尔顿 |