题目内容
14.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 | 0.075 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 | -3 |
| A. | T的氢化物水溶液呈酸性 | |
| B. | L、M的单质与稀盐酸反应速率:M>L | |
| C. | R的氢化物H2R分子中有10个电子 | |
| D. | L、Q形成的简单离子核外电子数相等 |
分析 短周期元素中,Q和R的化合价都有-2价,处于ⅥA族,Q的最高价为+6价,且原子半径较大,故Q为S元素,R为O元素;M的化合价为+3价,处于ⅢA族,M原子半径大于硫,故M为Al;L化合价为+2价,处于ⅡA族,且原子半径大于Al,故L为Mg;T的化合价为-3,处于VA族,原子半径与O相差不大且小于S,故T为N元素,结合元素周期律与元素化合物性质解答.
解答 解:短周期元素中,Q和R的化合价都有-2价,处于ⅥA族,Q的最高价为+6价,且原子半径较大,故Q为S元素,R为O元素;M的化合价为+3价,处于ⅢA族,M原子半径大于硫,故M为Al;L化合价为+2价,处于ⅡA族,且原子半径大于Al,故L为Mg;T的化合价为-3,处于VA族,原子半径与O相差不大且小于S,故T为N元素.
A.T的氢化物为NH3,其水溶液呈碱性,故A错误;
B.金属性Mg>Al,故单质与稀盐酸反应速率:Mg>Al,故B错误;
C.H2O分子中有10个电子,故C正确;
D.Mg2+核外有10个电子,S2-核外有18个电子,二者核外电子数不同,故D错误.
故选:C.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,根据化合价、原子半径推断元素是解答该题的关键,注意元素周期律的递变规律的应用.

练习册系列答案
相关题目
4.下列说法中,错误的是( )
| A. | 原子间通过共用电子形成的化学键叫共价键 | |
| B. | 对双原子分子来说,键能越大,断开时需要的能量越多,该化学键越不牢固 | |
| C. | 一般而言,化学键的键长越短,键越牢固,分子越稳定 | |
| D. | 成键原子间原子轨道重叠得越多,共价键越牢固 |
5.海水资源的利用具有广阔前景.海水中主要离子的含量如下:
利用海水可以提取溴和镁,提取过程如下:
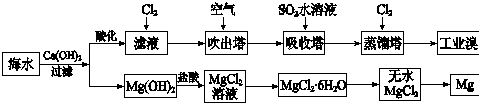
(1)提取溴的过程中,经过2次Br-→Br2转化的目的是对溴元素进行富集,吸收塔中发生反应的化学方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(2)Mg(OH)2中加盐酸的反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O.
(3)写出无水MgCl2得到Mg的化学方程式MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2溶解).
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是对溴元素进行富集,吸收塔中发生反应的化学方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(2)Mg(OH)2中加盐酸的反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O.
(3)写出无水MgCl2得到Mg的化学方程式MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2溶解).
2.对于第二周期从左到右的主族元素,下列说法中不正确的是( )
| A. | 原子半径逐渐减小 | B. | 最外层电子数逐渐增多 | ||
| C. | 最高正化合价逐渐增大 | D. | 元素的非金属性逐渐增强 |
9.下列说法中错误的是( )
| A. | 在周期表中,原子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 室温时,零族元素的单质都是气体 | |
| D. | 位于 IA的元素与位于 VIIA的元素组成的化合物都是离子化合物 |
19.“原子结构模型”是科学家根据自己的认识,对原子结构的形象描摹,一种模型代表了人类某一阶段对原子结构的认识.人们对原子结构的描摹,按现代向过去顺序排列为:电子云模型、玻尔原子模型、卢瑟福原子模型、 原子模型、 原子模型.则横线内两位化学家是( )
| A. | 阿伏加德罗、汤姆生 | B. | 道尔顿、拉瓦锡 | ||
| C. | 舍勒、普利斯特里 | D. | 汤姆生、道尔顿 |
6.将体积比1:4的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论叙述不正确的是( )
| A. | 产物中只有四氯化碳分子是正四面体结构 | |
| B. | 瓶中气体的黄绿色逐渐变浅,瓶内壁有油状液滴形成 | |
| C. | 若日光直射,可能发生爆炸 | |
| D. | 生成物只有CCl4、HCl |
4.下列物质中,不属于合成材料的是( )
| A. | 陶瓷 | B. | 橡胶 | C. | 塑料 | D. | 涤纶 |
