题目内容
12.下列分子中各原子都满足8e-结构的是( )| A. | SO2 | B. | CH4 | C. | PCl3 | D. | PCl5 |
分析 分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断.
解答 解:A、SO2中S元素化合价为+4,S原子最外层电子数为6,所以4+6=10,分子中S原子不满足8电子结构;O元素化合价为-2,O原子最外层电子数为6,所以|-2|+6=8,分子中O原子满足8电子结构,故A错误;
B.CH4中,C原子的最外层电子数为4+4=8,H原子的最外层电子数=1+1=2,故B错误;
C.PCl3中,P原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|-1|=8,都满足8电子稳定结构,故C正确;
D、PCl5中,P原子的最外层电子为:5+5=10,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故D错误.
故选C.
点评 本题考查原子的结构,难度不大注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答.

练习册系列答案
相关题目
2.下列分子式中只表示一种分子的是( )
| A. | C3H6 | B. | C2H6O | C. | C3H8 | D. | C3H6O2 |
3.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)11种元素中,化学性质最不活泼的是Ar.
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH.
(3)②③④中形成的简单离子半径由大到小的顺序是K+>Ca2+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,该氢化物常温下和元素②的单质反应的离子方程式是2K+2H2O═2K++2OH-+H2↑,该氢化物与元素⑧的单质反应的离子方程式是Cl2+H2O═H++Cl-+HClO.
(5)①和⑨的最高价氧化物对应的水化物的化学式为NaOH和HBrO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-═2Cl-+Br2.
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3═NaAlO2+2H2O.
(7)⑥和⑧形成的化合物的化学式为CCl4,该化合物溶解⑨的单质所得溶液为溴的CCl4溶液.
(8)⑧⑨⑪三种元素形成的气态氢化物最稳定的是HF.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑪ | |||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是KOH.
(3)②③④中形成的简单离子半径由大到小的顺序是K+>Ca2+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,该氢化物常温下和元素②的单质反应的离子方程式是2K+2H2O═2K++2OH-+H2↑,该氢化物与元素⑧的单质反应的离子方程式是Cl2+H2O═H++Cl-+HClO.
(5)①和⑨的最高价氧化物对应的水化物的化学式为NaOH和HBrO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-═2Cl-+Br2.
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3═NaAlO2+2H2O.
(7)⑥和⑧形成的化合物的化学式为CCl4,该化合物溶解⑨的单质所得溶液为溴的CCl4溶液.
(8)⑧⑨⑪三种元素形成的气态氢化物最稳定的是HF.
7.元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质与水剧烈反应产生氧气.则下列判断不正确的是( )
| R | ||
| X | T | Z |
| Q |
| A. | 非金属性:X<T<Z | B. | R和Q的电子数差为26 | ||
| C. | 气态氢化物稳定性:R<T<Z | D. | 最高价含氧酸酸性:T>Q |
17.硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等.利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如图1:
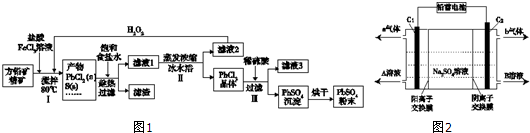
已知:(ⅰ)PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
(ⅱ)有关物质的Ksp和沉淀时的pH如下:
(1)步骤Ⅰ中生成PbCl2的离子方程式PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓,加入盐酸控制pH值小于2,原因是抑制Fe3+、Pb2+的水解,防止生成Fe(OH)3、Pb(OH)2沉淀.
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出.若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是Fe3+水解生成Fe(OH)3胶体,吸附溶液中悬浮杂质,被共同沉淀.
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)=PbSO4(s)+2Cl-(aq).
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为PbSO4+2e-=Pb+SO42-.
(6)双隔膜电解池的结构示意简图如图2所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是AD
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑

已知:(ⅰ)PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
| Ksp | 开始沉淀时pH | 完全沉淀时pH | ||
| PbSO4 | 1.08×10-8 | Fe (OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Pb( OH)2 | 6 | 7.04 |
(1)步骤Ⅰ中生成PbCl2的离子方程式PbS+2Fe3++2Cl-=PbCl2↓+2Fe2++S↓,加入盐酸控制pH值小于2,原因是抑制Fe3+、Pb2+的水解,防止生成Fe(OH)3、Pb(OH)2沉淀.
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出.若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是Fe3+水解生成Fe(OH)3胶体,吸附溶液中悬浮杂质,被共同沉淀.
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)=PbSO4(s)+2Cl-(aq).
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为PbSO4+2e-=Pb+SO42-.
(6)双隔膜电解池的结构示意简图如图2所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是AD
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑
4.下列说法中,错误的是( )
| A. | 原子间通过共用电子形成的化学键叫共价键 | |
| B. | 对双原子分子来说,键能越大,断开时需要的能量越多,该化学键越不牢固 | |
| C. | 一般而言,化学键的键长越短,键越牢固,分子越稳定 | |
| D. | 成键原子间原子轨道重叠得越多,共价键越牢固 |
1.下列反应的化学方程式或离子方程式表示正确的是( )
| A. | 1,3-丁二烯的1,2-加成:H2C=CHCH=CH2+Cl2→CH2ClCH=CHCH2Cl | |
| B. | 甲苯和氯气光照条件下发生反应: | |
| C. | 用醋酸去除水垢:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH4)2OH$\stackrel{水浴加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O |
2.对于第二周期从左到右的主族元素,下列说法中不正确的是( )
| A. | 原子半径逐渐减小 | B. | 最外层电子数逐渐增多 | ||
| C. | 最高正化合价逐渐增大 | D. | 元素的非金属性逐渐增强 |