题目内容
14.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ;
;(2)用电子式表示B和C形成的化合物
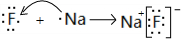 ;
;(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为
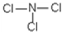 .
.
分析 短周期元素A、B、C、D、E的原子序数依次增大,A的最高正价和最低负价的绝对值之差为2,则A的最高正价为+5,负价为-3,所以A为ⅤA族元素,结合原子序数大小可知A为N元素;
1molC单质能与冷水反应,在标准状况下生成11.2LH2,氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,则1molC完全反应失去1mol电子,则C为Na元素;
D的原子最外层电子数等于其周期序数,D的原子序数大于Na,则D为第三周期第ⅢA族元素,为Al元素;
E的负一价阴离子的电子层结构与Ar原子相同,其质子数为18-1=17,所以E为Cl元素,B与E同主族,则B为F元素,
根据以上分析并结合元素周期律的知识进行解答.
解答 解:短周期元素A、B、C、D、E的原子序数依次增大,A的最高正价和最低负价的绝对值之差为2,则A的最高正价为+5,负价为-3,所以A为ⅤA族元素,结合原子序数大小可知A为N元素;1molC单质能与冷水反应,在标准状况下生成11.2LH2,氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,则1molC完全反应失去1mol电子,则C为Na元素;D的原子最外层电子数等于其周期序数,D的原子序数大于Na,则D为第三周期第ⅢA族元素,为Al元素;E的负一价阴离子的电子层结构与Ar原子相同,其质子数为18-1=17,所以E为Cl元素,B与E同主族,则B为F元素,
(1)D为Al,原子序数为13,其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)B为F、C为Na,二者形成的化合物为NaF,氟化钠为离子化合物,用电子式表示F与Na形成NaF的形成过程为: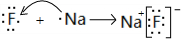 ,
,
故答案为: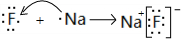 ;
;
(3)B为F元素、D为Al元素,氟离子和铝离子都具有相同的核外电子排布,核电荷数越大,离子半径越小,则离子半径大小为:F->Al3+,
故答案为:F->Al3+;
(4)a.比较两种单质的颜色:不能利用物理性质(如颜色、状态)来比较非金属性,故a正确;
b.比较氢化物的稳定性:氢化物越稳定,则对应非金属的非金属性越强,可以据此判断非金属性强弱,故b错误;
c.依据两元素在周期表的位置:根据元素在周期表中的位置,利用元素周期律知识可以判断二者的非金属性,故c错误;
d.比较原子半径大小:二者处于同一主族,原子半径越大,说明原子序数越大,则非金属性越弱,可以据此判断二者的非金属性,故d错误;
e.比较最高价氧化物对应水化物的酸性:F没有最高价正价,则无法据此判断二者非金属性,故e错误;
故答案为:ae;
(5)A为N元素,N元素能与F、Na、Al、Cl四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5,该化合物中N元素的化合价为-3,则另一种元素的化合价为-1价,可能为F或Cl元素,结合相对分子质量可知该元素为Cl,该化合物的化学式为:NCl3,分子中N原子与Cl原子之间形成1对共用电子对,则该物质的结构式为: ,
,
故答案为: .
.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素为解答关键,注意熟练掌握元素周期表结构、元素周期律内容,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

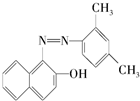 已知氮氮双键不能与Br2发生加成反应.苏丹红是很多国家禁止用于食品生产的合成色素,结构简式如图.下列关于苏丹红的说法中错误的是( )
已知氮氮双键不能与Br2发生加成反应.苏丹红是很多国家禁止用于食品生产的合成色素,结构简式如图.下列关于苏丹红的说法中错误的是( )| A. | 苏丹红属于芳香烃 | |
| B. | 苏丹红能与FeCl3溶液发生显色反应 | |
| C. | 苏丹红能被酸性KMnO4溶液氧化 | |
| D. | 1 mol苏丹红最多可与1 mol Br2发生取代反应 |
| A. | Mg为电池的负极 | B. | 正极反应为:AgCl+e-═Ag+Cl- | ||
| C. | 不能被KCl 溶液激活 | D. | 可用于海上应急照明供电 |
| A. | 乙烷(乙炔):通过盛溴水的洗气瓶 | |
| B. | 乙酸乙酯(乙醇):加入乙酸和浓硫酸的混合液,然后加热 | |
| C. | 苯(苯酚):加入氢氧化钠溶液,然后分液 | |
| D. | 乙醇(水):加入生石灰,然后蒸馏 |
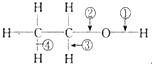 下列关于乙醇在各种不同反应中断裂键的说明中,正确的是( )
下列关于乙醇在各种不同反应中断裂键的说明中,正确的是( )| A. | 和金属钠反应,键③断裂 | B. | 和金属钠反应,键②断裂 | ||
| C. | 在Cu催化下和O2反应,键①、③断裂 | D. | 在Cu催化下和O2反应,键②、③断裂 |
| A. | 相同体积、相同pH的三种溶液:①CH3COOH、②HCl、③H2SO4,中和NaOH的物质的量由大到小的顺序是:①>③>② | |
| B. | NaHCO3溶液中有:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 相同浓度的下列溶液:①CH3COONH4、②CH3COONa、③CH3COOH中,c(CH3COO-)由大到小的顺序是:②>①>③ | |
| D. | pH=4的Al2(SO4)3溶液中,水电离出H+的物质的量浓度为10-10mol•L-1 |
| A. | NaHSO4 和 Ba(OH)2 | B. | MgCl2和 NH3•H2O | C. | NaAlO2 和 H2SO4 | D. | AlCl3 和 NaOH |
| A. | H、D、T互为同素异形体 | B. | 乙醇的分子式:C2H6O | ||
| C. | NH4Cl的电子式: | D. | 羟基的电子式: |