题目内容
4.正确掌握化学用语是学好化学的基础,下列化学用语中正确的是( )| A. | H、D、T互为同素异形体 | B. | 乙醇的分子式:C2H6O | ||
| C. | NH4Cl的电子式: | D. | 羟基的电子式: |
分析 A.同种元素的不同单质互称同素异形体;
B.乙醇分子中含有2个C、6个H和1个氧原子;
C.氯化铵的电子式中氯离子没有标出最外层电子;
D.羟基为中性原子团,氧原子最外层为7个电子.
解答 解:A.同种元素的不同单质互称同素异形体,H、D、T均为原子,属于同位素,故A错误;
B.乙醇分子中含有2个C、6个H和1个氧原子,乙醇的分子式为:C2H6O,故B正确;
C.氯化铵的电子式中氯离子没有标出最外层电子,NH4Cl正确的电子式为: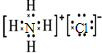 ,故C错误;
,故C错误;
D.羟基是电中性基团,氧原子与氢原子以1对共用电子对连接,电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了化学用语的表示方法判断,题目难度中等,涉及同位素和同素异形体、电子式、分子式等知识,明确常见化学用语的书写原则为解答关键,注意把握离子化合物与共价化合物的电子式的书写方法及区别.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
14.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)D原子结构示意图为 ;
;
(2)用电子式表示B和C形成的化合物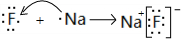 ;
;
(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为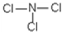 .
.
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ;
;(2)用电子式表示B和C形成的化合物
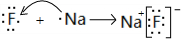 ;
;(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为
 .
.
15.下列物质中,物质的量最多的是( )
| A. | 4℃时40ml水 | B. | 0.8mol硫酸 | ||
| C. | 9.03×1022个氧分子 | D. | 54g铝 |
16.下列有关钠和镁的说法中,不正确的是( )
| A. | 工业上通过电解氯化钠溶液制取金属钠 | |
| B. | 金属镁在空气燃烧后的产物除MgO外,还有Mg3N2和C等 | |
| C. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| D. | 钠可用于从钛、铌等金属的氯化物中置换出金属单质 |
6.分子式为C4H8烯烃的同分异构体(包括顺反异构)有( )种.
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
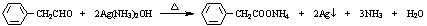 .
.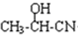 $→_{H_{2}O}^{HCI}$
$→_{H_{2}O}^{HCI}$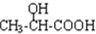 ,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色.
,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色. ;
;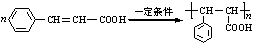 .
. ,1mol戊与过量盐酸反应的离子方程式是N2H4+2H+═N2H62+ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是N2H4中氮元素的化合价为-2价,既可以升高,又可以降低;8g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.
,1mol戊与过量盐酸反应的离子方程式是N2H4+2H+═N2H62+ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是N2H4中氮元素的化合价为-2价,既可以升高,又可以降低;8g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.