题目内容
5.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg═Mg2++2Ag+2Cl-.有关该电池的说法不正确的是( )| A. | Mg为电池的负极 | B. | 正极反应为:AgCl+e-═Ag+Cl- | ||
| C. | 不能被KCl 溶液激活 | D. | 可用于海上应急照明供电 |
分析 根据电池反应式知,Mg元素化合价由0价变为+2价,则Mg作负极,AgCl作正极,负极反应式为Mg-2e-═Mg2+,正极反应式为AgCl+e-═Ag+Cl-,据此分析解答.
解答 解:A.根据元素化合价变化知,Mg元素化合价由0价变为+2价,则Mg作负极,故A正确;
B.AgCl是正极,正极上得电子发生还原反应,电极反应式为AgCl+e-═Ag+Cl-,故B正确;
C.电池是一种能被海水激活的一次性贮备电池,所以KCl溶液也可以激活电池,故C错误;
D.电池是一种能被海水激活的一次性贮备电池,电池工作时将化学能转化为电能,电能的产生可用于海上应急照明供电,故D正确;
故选C.
点评 本题考查化学电源新型电池,为高频考点,会根据电池反应式确定正负极,难点是电极反应式的书写,同时还考查学生获取信息利用信息能力,易错选项是C.

练习册系列答案
相关题目
16.下列物质与其用途相符合的是( )
①NaClO-漂白纺织物 ②NaHCO3-治疗胃酸过多 ③明矾-做干燥剂 ④硅-做光导纤维 ⑤Na2O2-呼吸面具的供氧剂.
①NaClO-漂白纺织物 ②NaHCO3-治疗胃酸过多 ③明矾-做干燥剂 ④硅-做光导纤维 ⑤Na2O2-呼吸面具的供氧剂.
| A. | ②④⑤ | B. | ①②⑤ | C. | ①②④⑤ | D. | 全部 |
13.下列离子方程式书写不正确的是( )
| A. | 向H2SO4酸化的KI溶液中滴加H2O2:2I-+H2O2+2H+=I2+2H2O | |
| B. | 小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| C. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO | |
| D. | 检验溴乙烷中含有的溴元素:CH3CH2Br+Ag+=AgBr↓+CH3CH2+ |
10.下列条件下,两种气体的分子数一定相等的是( )
| A. | 同质量不同密度的C2H4和CO | B. | 同温度同体积的C2H4和NO | ||
| C. | 同温度同压强的CO和N2 | D. | 同体积同压强的N2和N2H4 |
14.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)D原子结构示意图为 ;
;
(2)用电子式表示B和C形成的化合物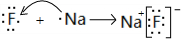 ;
;
(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为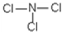 .
.
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ;
;(2)用电子式表示B和C形成的化合物
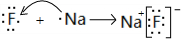 ;
;(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为
 .
.
15.下列物质中,物质的量最多的是( )
| A. | 4℃时40ml水 | B. | 0.8mol硫酸 | ||
| C. | 9.03×1022个氧分子 | D. | 54g铝 |

 或
或 等
等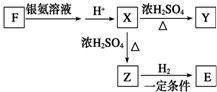 已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题:
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题: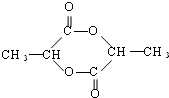 +2H2O.
+2H2O.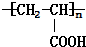 .
.