��Ŀ����
19����ӦN2��g��+3H2��g��$\frac{\underline{����}}{��}$2NH3��g����H��0���ڵ��������½��У��ı�������Ӧ��������I��II��III����ϵ��c��H2����c��NH3����ʱ��仯��������ͼ1��ʾ����ش��������⣺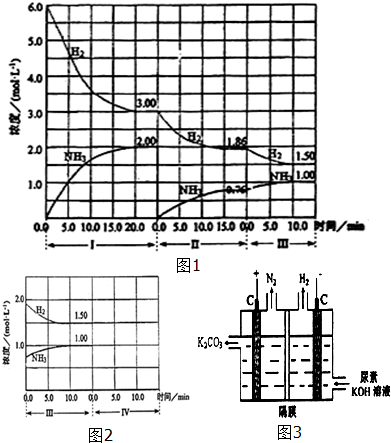
��1��N2��ƽ����Ӧ����vI��N2����vII��N2����vIII��N2���Ӵ�С���д���Ϊv����N2����v����N2����v����N2����
��2���Ƚϵ�II�η�Ӧ�¶ȣ�T2���͵�III�η�Ӧ�¶ȣ�T3���ĸߵͣ�T2��T3�����������=�����������жϵ������Ǵ˷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���ƽ����ƶ�ֻ�ܼ����ı䣬���ܵ����ı䣮
��3���ﵽ������ƽ����������������һ�����ٶ�10min��ﵽ�µ�ƽ�⣬����ͼ2�������߱�ʾIV����ϵ��c��H2����c��NH3����ʱ��仯�����ߣ������ϱ������������ʣ���
��4��������ʾ��
�ٽ�����ͨ��˫��ˮ�пɷ�����Ӧ��3H2O2+2NH3=N2+6H2O��H��0���˷�Ӧ����Ƴ�ԭ��أ�
������ͼ3��ʾװ�õ������[CO��NH2��2]�ļ�����Һ������ȡN2��H2��ע�������и�Ĥ����ֹ����ͨ����
����ԭ��ص�������ӦʽΪH2O2+2e-=2OH-���������ص�������ӦʽΪCO��NH2��2+8OH--6e-=CO32-+N2��+6H2O��
���� ��1�����ݻ�ѧ��Ӧ����֮�ȵ���ϵ��֮�ȣ���ͨ��ͼ��Ƚ���ͬʱ�����������ĵ�б�ʱȽϻ�ѧ��Ӧ���ʣ��ݴ��жϣ�
��2���ڢ�εĿ�ʼ��ڢ�ε�ƽ������ʵ�������ȣ�����H2�������٣�NH3�������ӿ��ж�ƽ���������ƶ��ģ�����ƽ�ʼʱŨ��ȷ����ƽ���ƶ�����������Ũ�ȵı仯����ģ�������Ŀ��������������������䣬��ı�ѹǿҲ�����ܣ����һ��Ϊ�¶ȵ�Ӱ�죬�˷�Ӧ����Ϊ���ȷ�Ӧ�������Ʋ�Ϊ�����¶ȣ�������A�������������ε������ȷ���ı������һ��Ϊ�����¶ȣ�������������ԭ����ƽ����ƶ�ֻ�ܼ����ı䣬���ܵ����ı䣬��˴ﵽƽ����¶�һ���ȵڢ��ƽ��ʱ���¶ȵͣ�
��3���ﵽ������ƽ����������������һ�����ı�������˲�䣬����ֵ�Ũ�ȱ�Ϊԭ���Ķ���֮һ�������������ѹǿ����ƽ�����������ķ����ƶ�������������ʵ���Ũ��С�ڵ�����ƽ��ʱŨ�ȣ�ͬʱע���������ʵ���Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ��ݴ���ͼ��
��4��3H2O2+2NH3=N2+6H2O��H��0���˷�Ӧ����Ƴ�ԭ��أ������õ��ӷ�����ԭ��Ӧ����ͼ��֪��CO��NH2��2�������ŵ�����N2��CԪ�ؼ�̬δ�仯���ʻ���̼���������ˮ���ɣ�
��� �⣺��1����Ϊ��ѧ��Ӧ����֮�ȵ���ϵ��֮�ȣ����ԱȽϵ��������൱�ڱȽ��������ʣ��ֿ�ͨ��ͼ��Ƚ���ͬʱ�����������ĵ�б�ʱȽϻ�ѧ��Ӧ���ʣ���������ƽ����Ӧ����v����H2����v����H2����v����H2����������ƽ����Ӧ����v����N2����v����N2����v����N2����
�ʴ�Ϊ��v����N2����v����N2����v����N2����
��2���ڢ�εĿ�ʼ��ڢ�ε�ƽ������ʵ�������ȣ�����H2�������٣�NH3�������ӿ��ж�ƽ���������ƶ��ģ�����ƽ�ʼʱŨ��ȷ����ƽ���ƶ�����������Ũ�ȵı仯����ģ�������Ŀ��������������������䣬��ı�ѹǿҲ�����ܣ����һ��Ϊ�¶ȵ�Ӱ�죬�˷�Ӧ����Ϊ���ȷ�Ӧ�������Ʋ�Ϊ�����¶ȣ�������H2�������������ε������ȷ���ı������һ��Ϊ�����¶ȣ�������������ԭ����ƽ����ƶ�ֻ�ܼ����ı䣬���ܵ����ı䣬��˴ﵽƽ����¶�һ���ȵڢ��ƽ��ʱ���¶ȵͣ�
�ʴ�Ϊ�������˷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���ƽ����ƶ�ֻ�ܼ����ı䣬���ܵ����ı䣻
��3���ﵽ������ƽ����������������һ�����ı�������˲�䣬����ֵ�Ũ�ȱ�Ϊԭ���Ķ���֮һ�������������ѹǿ����ƽ�����淴Ӧ�����ƶ�������������ʵ���Ũ��С�ڵ�����ƽ��ʱŨ�ȣ�ͬʱע���������ʵ���Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ�A��B��C��Ũ����ʱ��仯��������ͼ��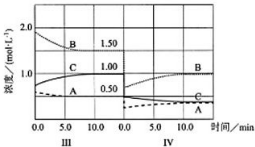 ���ʴ�Ϊ��
���ʴ�Ϊ��
��4��3H2O2+2NH3=N2+6H2O��H��0���˷�Ӧ����Ƴ�ԭ��أ������õ��ӷ�����ԭ��Ӧ����ӦʽΪH2O2+2e-=2OH-��
CO��NH2��2��A���ŵ�����N2����Ӧ����ʽΪ��CO��NH2��2+8OH--6e-=CO32-+N2��+6H2O��
�ʴ�Ϊ��H2O2+2e-=2OH-��CO��NH2��2+8OH--6e-=CO32-+N2��+6H2O��
���� ���⿼�黯ѧ��Ӧ�����뻯ѧƽ��ͼ��ѧ��Ӧ���ʡ���ѧƽ��Ӱ�������Լ��缫��Ӧʽ����д�ȣ��Ѷ��еȣ���3������ͼΪ�״��㣬ѧ������ֻ���Ǹı�˲������ʵ�Ũ�ȣ���ע��ƽ��ʱ������Ũ�ȵı仯����

 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�| A�� | ͬ������ͬ�ܶȵ�C2H4��CO | B�� | ͬ�¶�ͬ�����C2H4��NO | ||
| C�� | ͬ�¶�ͬѹǿ��CO��N2 | D�� | ͬ���ͬѹǿ��N2��N2H4 |
| A�� | ԭ������������Ϊ2��Ԫ��һ���ǽ���Ԫ�� | |
| B�� | HF��HCl��HBr��HI�����ȶ��Ժͻ�ԭ�Զ�������ǿ | |
| C�� | ������������Ǽ��������� | |
| D�� | ������XY3�У�X���ܳ�-3�ۣ�Y���ܳ�+1�� |
| Ԫ�ر�� | Ԫ��������Ϣ |
| A | ������ۺ�����۵ľ���ֵ֮��Ϊ2 |
| B | ��Eͬ���� |
| C | 1mol��C����������ˮ��Ӧ���ڱ�״��������11.2L��H2 |
| D | ԭ�������������������������� |
| E | ��һ�������ӵĵ��Ӳ�ṹ��Arԭ����ͬ |
 ��
����2���õ���ʽ��ʾB��C�γɵĻ�����
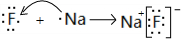 ��
����3��B��D�����ӵİ뾶��СΪF-��Al3+���������ӷ��ź͡���������=��������ʾ��
��4��Ԫ�طǽ�����ǿ���Ƚ��кܶ��������B��E�ķǽ�����ǿ�����о������в����е���ae ������ţ���
a���Ƚ����ֵ��ʵ���ɫb���Ƚ��⻯����ȶ��� c��������Ԫ�������ڱ���λ��
d���Ƚ�ԭ�Ӱ뾶��С e���Ƚ�����������Ӧˮ���������
��5��EԪ��������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����Է�������Ϊ120.5��������ʵĽṹʽΪ
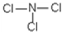 ��
�� 
| A�� | ����������ʵ���Ũ��Ϊ9.2 mol•L-1 | |
| B�� | 1 mol �����뵽�����ĸ������У��ɲ���2 g H2 | |
| C�� | ���������������ˮ���������Һ�����ʵ���Ũ�ȴ���9.2 mol•L-1 | |
| D�� | ����200 mL 4.6 mol•L-1��������Һ��ȡ������50 mL |
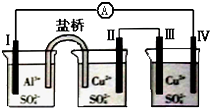
| A�� | �缫�����ܽ� | B�� | �缫����������Ӧ | ||
| C�� | �������缫���A���缫�� | D�� | �缫��ĵ缫��Ӧ��Cu2++2e-=Cu |
| A�� | c��CH3COO -����c��CH3COOH�� | B�� | c��CH3COO -����c��Na+����c��H+����c��OH -�� | ||
| C�� | c��Na+��=c��CH3COO -��=0.01mol•L-1 | D�� | c��CH3COOH��+c��CH3COO -��=0.02mol•L-1 |
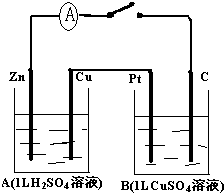
 ��1mol����������ᷴӦ�����ӷ���ʽ��N2H4+2H+�TN2H62+ ����������ԭ��Ӧ����H2O2���ƣ��ȿ������������ֿ�����ԭ�������ݼ�̬�����������������ԭ����N2H4�е�Ԫ�صĻ��ϼ�Ϊ-2�ۣ��ȿ������ߣ��ֿ��Խ��ͣ�8gҺ̬����Һ̬˫��ˮǡ����ȫ��Ӧ�������������ֲ���Ⱦ��������̬���ʣ��ų�375kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽN2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-1 500 kJ/mol��
��1mol����������ᷴӦ�����ӷ���ʽ��N2H4+2H+�TN2H62+ ����������ԭ��Ӧ����H2O2���ƣ��ȿ������������ֿ�����ԭ�������ݼ�̬�����������������ԭ����N2H4�е�Ԫ�صĻ��ϼ�Ϊ-2�ۣ��ȿ������ߣ��ֿ��Խ��ͣ�8gҺ̬����Һ̬˫��ˮǡ����ȫ��Ӧ�������������ֲ���Ⱦ��������̬���ʣ��ų�375kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽN2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-1 500 kJ/mol��