题目内容
2.下列除去括号内杂质的有关操作方法不正确的是( )| A. | 乙烷(乙炔):通过盛溴水的洗气瓶 | |
| B. | 乙酸乙酯(乙醇):加入乙酸和浓硫酸的混合液,然后加热 | |
| C. | 苯(苯酚):加入氢氧化钠溶液,然后分液 | |
| D. | 乙醇(水):加入生石灰,然后蒸馏 |
分析 A.乙炔和溴发生加成反应生成1,1,2,2-二溴乙烷,乙烷和溴不反应;
B.乙醇和乙酸的反应是可逆反应且引进新的杂质;
C.苯酚和NaOH溶液反应生成可溶性的苯酚钠,苯和NaOH不反应且和水不互溶;
D.水和生石灰反应,乙醇和生石灰不反应.
解答 解:A.乙炔和溴发生加成反应生成1,1,2,2-二溴乙烷,乙烷和溴不反应,所以可以用溴水采用洗气方法除去乙烷中的乙炔,故A正确;
B.乙醇和乙酸的反应是可逆反应且引进新的杂质,应该用饱和碳酸钠溶液除去乙醇,然后采用分液方法分离,故B错误;
C.苯酚和NaOH溶液反应生成可溶性的苯酚钠,苯和NaOH不反应且和水不互溶,然后采用分液方法分离,故C正确;
D.氧化钙可与水反应生成难挥发的氢氧化钙,乙醇和氧化钙不反应,所以可用加生石灰蒸馏的方法分离,故D正确;
故选B.
点评 本题考查物质分离、提纯,明确物质的性质是解本题关键,利用物质性质的差异性选取合适的试剂,知道常见物质分离、提纯方法,题目难度不大,易错选项是B.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列离子方程式书写不正确的是( )
| A. | 向H2SO4酸化的KI溶液中滴加H2O2:2I-+H2O2+2H+=I2+2H2O | |
| B. | 小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| C. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO | |
| D. | 检验溴乙烷中含有的溴元素:CH3CH2Br+Ag+=AgBr↓+CH3CH2+ |
10.下列条件下,两种气体的分子数一定相等的是( )
| A. | 同质量不同密度的C2H4和CO | B. | 同温度同体积的C2H4和NO | ||
| C. | 同温度同压强的CO和N2 | D. | 同体积同压强的N2和N2H4 |
7.下列说法中,正确的是( )
| A. | 原子最外层电子数为2的元素一定是金属元素 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性都依次增强 | |
| C. | 金属氧化物就是碱性氧化物 | |
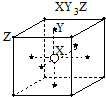
| D. | 化合物XY3中,X可能呈-3价,Y可能呈+1价 |
14.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)D原子结构示意图为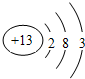 ;
;
(2)用电子式表示B和C形成的化合物 ;
;
(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为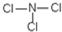 .
.
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ;
;(2)用电子式表示B和C形成的化合物
 ;
;(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为
 .
.
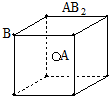
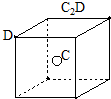
11.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其它均为Cu,则( )


| A. | 电极Ⅱ逐渐溶解 | B. | 电极Ⅰ发生氧化反应 | ||
| C. | 电流方向:电极Ⅰ→A→电极Ⅳ | D. | 电极Ⅲ的电极反应:Cu2++2e-=Cu |
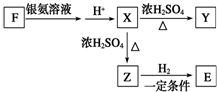 已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题:
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题: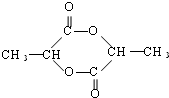 +2H2O.
+2H2O.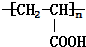 .
.