题目内容
6.下列说法正确的是( )| A. | 相同体积、相同pH的三种溶液:①CH3COOH、②HCl、③H2SO4,中和NaOH的物质的量由大到小的顺序是:①>③>② | |
| B. | NaHCO3溶液中有:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 相同浓度的下列溶液:①CH3COONH4、②CH3COONa、③CH3COOH中,c(CH3COO-)由大到小的顺序是:②>①>③ | |
| D. | pH=4的Al2(SO4)3溶液中,水电离出H+的物质的量浓度为10-10mol•L-1 |
分析 A、相同体积、相同pH的三种溶液,醋酸是弱酸存在电离平衡,盐酸和硫酸为强酸完全电离;
B、依据溶液中电荷守恒分析判断;
C、相同浓度的溶液中铵根水解促进醋酸根离子的水解,醋酸是弱酸电离程度微弱;
D、铝离子水解生成氢氧化铝和氢离子,溶液PH=4,水电离出氢离子浓度c(H+)=10-4mol/L.
解答 解:A、相同体积、相同pH的三种溶液,醋酸是弱酸存在电离平衡,盐酸和硫酸为强酸完全电离,中和NaOH的物质的量①>③=②,故A错误;
B、依据溶液中电荷守恒分析判断溶液中存在的电荷守恒为,c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-),故B错误;
C、相同浓度的溶液中铵根水解促进醋酸根离子的水解,醋酸是弱酸电离程度微弱,c(CH3COO-)由大到小的顺序是:②>①>③,故C正确;
D、铝离子水解生成氢氧化铝和氢离子,溶液中氢离子全部是水电离出的离子,溶液PH=4,水电离出氢离子浓度c(H+)=10-4mol/L,故D错误;
故选C.
点评 本题考查了酸的浓度与溶液中氢离子浓度的关系,酸碱中和反应的定量比较,弱电解质电离平衡分析判断等,明确酸的酸性强弱及溶液中氢离子的浓度与pH的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
16.下列物质与其用途相符合的是( )
①NaClO-漂白纺织物 ②NaHCO3-治疗胃酸过多 ③明矾-做干燥剂 ④硅-做光导纤维 ⑤Na2O2-呼吸面具的供氧剂.
①NaClO-漂白纺织物 ②NaHCO3-治疗胃酸过多 ③明矾-做干燥剂 ④硅-做光导纤维 ⑤Na2O2-呼吸面具的供氧剂.
| A. | ②④⑤ | B. | ①②⑤ | C. | ①②④⑤ | D. | 全部 |
14.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)D原子结构示意图为 ;
;
(2)用电子式表示B和C形成的化合物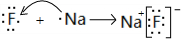 ;
;
(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为 .
.
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ;
;(2)用电子式表示B和C形成的化合物
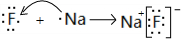 ;
;(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为
 .
.
1.下列有关图表示的反应叙述正确的是( )
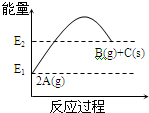

| A. | 1molC(s)的能量高于2molA(g)能量 | |
| B. | 该反应的热化学方程式为:2A(g)═B(g)+C(s)△H=(E1-E2)kJ/mol | |
| C. | 反应过程中当v(A)=0.4mol/(L•s),则v(C)=0.2mol/(L•s) | |
| D. | 该反应为吸热反应 |
11.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其它均为Cu,则( )
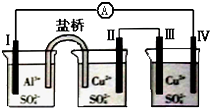

| A. | 电极Ⅱ逐渐溶解 | B. | 电极Ⅰ发生氧化反应 | ||
| C. | 电流方向:电极Ⅰ→A→电极Ⅳ | D. | 电极Ⅲ的电极反应:Cu2++2e-=Cu |
18.下列各组气体,常温下因发生非氧化还原反应而不能共存的是( )
| A. | HCl、NH3 | B. | SO2、O2 | C. | NO2、NO | D. | H2、Cl2 |
15.下列物质中,物质的量最多的是( )
| A. | 4℃时40ml水 | B. | 0.8mol硫酸 | ||
| C. | 9.03×1022个氧分子 | D. | 54g铝 |
16.下列有关钠和镁的说法中,不正确的是( )
| A. | 工业上通过电解氯化钠溶液制取金属钠 | |
| B. | 金属镁在空气燃烧后的产物除MgO外,还有Mg3N2和C等 | |
| C. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| D. | 钠可用于从钛、铌等金属的氯化物中置换出金属单质 |
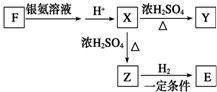 已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题:
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题: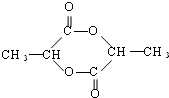 +2H2O.
+2H2O.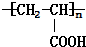 .
.