题目内容
9.乙醇分子中不同的化学键如图: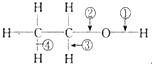 下列关于乙醇在各种不同反应中断裂键的说明中,正确的是( )
下列关于乙醇在各种不同反应中断裂键的说明中,正确的是( )| A. | 和金属钠反应,键③断裂 | B. | 和金属钠反应,键②断裂 | ||
| C. | 在Cu催化下和O2反应,键①、③断裂 | D. | 在Cu催化下和O2反应,键②、③断裂 |
分析 乙醇含有羟基,可发生取代、消去和氧化反应,与钠反应生成乙醇钠和氢气,催化氧化生成乙醛,以此解答该题.
解答 解:与Na反应生成氢气,O-H键断裂,即①断裂;
在Cu催化下与O2反应时,生成醛,C-H、O-H键断裂,则键①、③断裂,
故选C.
点评 本题考查有机物的结构与性质,侧重乙醇性质的考查,注意乙醇的性质与官能团、化学键的关系,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
19.由乙烯推测丙烯(CH2=CH-CH3)的结构或性质正确的是( )
| A. | 不能使酸性高锰酸钾溶液褪色 | |
| B. | 不能在空气中燃烧 | |
| C. | 能使溴水褪色 | |
| D. | 与HCl在一定条件下能加成只得到一种产物 |
4.下面有关晶体的叙述中,错误的是( )
| A. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| B. | 在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个Na+) | |
| C. | 白磷晶体中,粒子之间通过共价键结合,键角为60° | |
| D. | 离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏 |
14.短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)D原子结构示意图为 ;
;
(2)用电子式表示B和C形成的化合物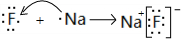 ;
;
(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为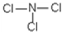 .
.
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ;
;(2)用电子式表示B和C形成的化合物
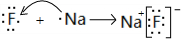 ;
;(3)B和D简单离子的半径大小为F->Al3+;(用离子符号和”>“、”=“或”<“表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是ae (填序号);
a.比较两种单质的颜色b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5.则该物质的结构式为
 .
.
1.下列有关图表示的反应叙述正确的是( )
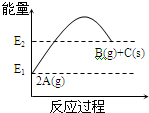

| A. | 1molC(s)的能量高于2molA(g)能量 | |
| B. | 该反应的热化学方程式为:2A(g)═B(g)+C(s)△H=(E1-E2)kJ/mol | |
| C. | 反应过程中当v(A)=0.4mol/(L•s),则v(C)=0.2mol/(L•s) | |
| D. | 该反应为吸热反应 |
18.下列各组气体,常温下因发生非氧化还原反应而不能共存的是( )
| A. | HCl、NH3 | B. | SO2、O2 | C. | NO2、NO | D. | H2、Cl2 |

 或
或 等
等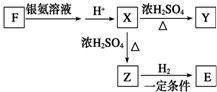 已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题:
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题: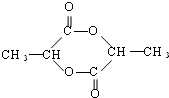 +2H2O.
+2H2O.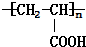 .
.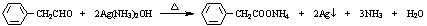 .
.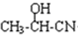 $→_{H_{2}O}^{HCI}$
$→_{H_{2}O}^{HCI}$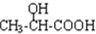 ,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色.
,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色. ;
;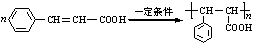 .
.