题目内容
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA |
分析 A.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算生成氢气的体积;
B.浓硫酸随着反应的进行会变成稀硫酸,稀硫酸不与铜反应,则反应生成的二氧化硫减少;
C.羟基中含有9个电子,1mol羟基中含有9mol电子;
D.常温下pH=12的溶液中氢氧根离子浓度为0.01mol/L,据此计算出10L溶液中含有的氢氧根离子.
解答 解:A.4.6g钠的物质的量为:$\frac{4.6g}{23g/mol}$=0.2mol,完全反应生成0.1mol氢气,标准状况下0.1mol氢气的体积约为2.24L,没有告诉在标况下,则氢气的体积不一定为2.24L,故A错误;
B.50mL 18.4mol/L的浓硫酸中H2SO4的物质的量=0.05L×18.4mol/L=0.92mol,若硫酸完全反应,由方程式可知生成二氧化碳的物质的量=0.92mol×$\frac{1}{2}$=0.46mol,由于Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应,故实际得到SO2小于0.46mol,故B错误;
C.1mol羟基中含有9mol电子,含电子数为9NA,故C错误;
D.常温下,10L pH=12的Na2CO3溶液中氢氧根离子浓度为0.01mol/L,含有氢氧根离子的物质的量为0.01mol/L×10L=0.1mol,含有的OH-离子数目为0.1NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
7.在元素周期表中有很多的规律与特点,下列说法不正确的是( )
| A. | 两种不同的元素不可能既在同一周期,又在同一主族 | |
| B. | 元素周期表中的元素不全是从自然界中发现的 | |
| C. | 周期表中共1-20号元素,含有非金属11种 | |
| D. | 若周期表中第8周期完全填满,此周期应含有有50种元素 |
14.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 | |
| C. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
11.在室温下,下列各组微粒在溶液中能大量共存的是( )
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、C6H5O-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
18.下列说法正确的是( )
| A. | 100℃时,KW=10-12,此温度下pH=6的溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,说明该溶液中c(HSO3-)>c(SO32-) | |
| C. | NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | |
| D. | 25℃时,10mL0.1mol/L CH3COOH溶液与5mL 0.1mol/LNaOH溶液混合,所得溶液中有2c(Na+)═c(CH3COO-)+c(CH3COOH) |
8.海洋是地球上最广阔的水体的总称,其含水量约占地球上总水量的97%.
(1)海水中含有许多化学物质,不能直接饮用,所以将海水转化为淡水是一项重大科研课题.电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示,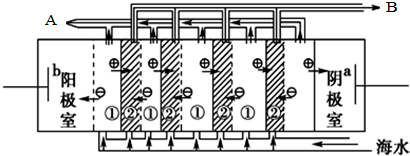 电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发池和结晶池,建盐田必须在BC处建立(填写序号).
A.选在离江河入海口比较近的地方B.多风少雨C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe3+、SO42-等离子,流程如下:
粗盐水$\stackrel{过量BaCl_{2}溶液}{→}$$\stackrel{过量Na_{2}CO_{3}溶液}{→}$$\stackrel{过量NaOH溶液}{→}$$\stackrel{过滤}{→}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20°C部分沉淀的溶解度(g)如下表:
①检测Fe3+是否除尽的方法是取过程 III的滤液于试管中,向其中滴加KSCN溶液,若溶液不变色证明Fe3+已经沉淀干净,反之没除净.
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
①检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净;
②样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
(1)海水中含有许多化学物质,不能直接饮用,所以将海水转化为淡水是一项重大科研课题.电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示,
 电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发池和结晶池,建盐田必须在BC处建立(填写序号).
A.选在离江河入海口比较近的地方B.多风少雨C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe3+、SO42-等离子,流程如下:
粗盐水$\stackrel{过量BaCl_{2}溶液}{→}$$\stackrel{过量Na_{2}CO_{3}溶液}{→}$$\stackrel{过量NaOH溶液}{→}$$\stackrel{过滤}{→}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20°C部分沉淀的溶解度(g)如下表:
| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
①检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净;
②样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| B. | 标准状况下,11.2 L CCl4中含有的分子数目为0.5NA | |
| C. | 28 g聚乙烯中含有的碳原子数目为2NA | |
| D. | 1 mol C${{H}_{5}}^{+}$中含有的电子数目为11NA |
12.下列有关说法正确的是( )
| A. | 电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变 | |
| B. | NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强 | |
| C. | SO3(g)+H2O(l)═H2SO4(aq)在常温下能自发进行,则该反应的△H<0 | |
| D. | 0.1 mo1•L-1 CH3COOH溶液加水稀释后,溶液中$\frac{{c(CH}_{3}C{OO}^{-1})}{{c(CH}_{3}COOH)}$的值减小 |
13.下列溶液中有关物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |