题目内容
12.下列有关说法正确的是( )| A. | 电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变 | |
| B. | NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强 | |
| C. | SO3(g)+H2O(l)═H2SO4(aq)在常温下能自发进行,则该反应的△H<0 | |
| D. | 0.1 mo1•L-1 CH3COOH溶液加水稀释后,溶液中$\frac{{c(CH}_{3}C{OO}^{-1})}{{c(CH}_{3}COOH)}$的值减小 |
分析 A、电解过程中,阳极上不仅有铜还有其它金属失电子;
B、二氧化碳与水反应生成碳酸,碳酸的酸性比次氯酸强;
C、△H-T△S<0时反应自发;
D、加水稀释促进CH3COOH电离,溶液中CH3COOH个数减少、CH3COO-个数增加.
解答 解:A、因为粗铜作阳极,该电极上Al、Zn、Cu失电子,精铜作阴极,该极上是铜离子得电子,所以溶液中的CuSO4溶液的浓度在减小,故A错误;
B、二氧化碳与水反应生成碳酸,碳酸的酸性比次氯酸强,可以与NaClO反应生成HClO,溶液显示酸性,故B错误;
C、△H-T△S<0时反应自发,该反应为气体减小的反应,则△S<0,反应能自发进行,△H必须小于0,故C正确;
D、加水稀释促进CH3COOH电离,溶液中CH3COOH个数减少、CH3COO-个数增加,所以$\frac{{c(CH}_{3}C{OO}^{-1})}{{c(CH}_{3}COOH)}$的值变大,故D错误;
故选:C.
点评 本题考查反应自发进行的条件、电解原理、化学平衡常数及平衡移动等知识,题目难度不大.

练习册系列答案
相关题目
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA |
20.下列说法正确的是( )
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)只能在高温下自发进行,则该反应△H>0 | |
| B. | 电镀时,镀层金属跟直流电源的负极相连 | |
| C. | 锅炉内壁上沉积的CaSO4可先用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | 向100 mL纯水中滴加1 mL浓硫酸,水的离子积常数Kw减小 |
7.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )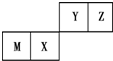

| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | Z位于元素周期表中第2周期第ⅥA族 |
4.常温下,下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | 在0.1 mol•L-1NaOH溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- | |
| C. | 在0.1 mol•L-1FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{{c(H}^{+})}{{c(OH}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
1.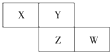 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的弱 | |
| D. | X与Y形成的化合物都易溶于水 |
2.下列叙述正确的是( )
| A. | 等质量的铜分别与足量稀硝酸和浓硝酸充分反应,生成气体的物质的量相同 | |
| B. | 等质量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同 | |
| C. | 等质量的铝分别与足量氢氧化钠溶液和盐酸充分反应,生成气体的体积一定相同 | |
| D. | 等质量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同 |
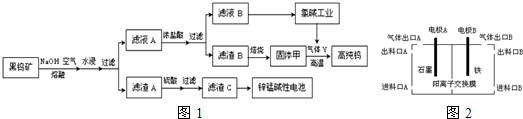
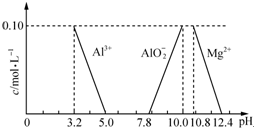 达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.
达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.