题目内容
18.下列说法正确的是( )| A. | 100℃时,KW=10-12,此温度下pH=6的溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,说明该溶液中c(HSO3-)>c(SO32-) | |
| C. | NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | |
| D. | 25℃时,10mL0.1mol/L CH3COOH溶液与5mL 0.1mol/LNaOH溶液混合,所得溶液中有2c(Na+)═c(CH3COO-)+c(CH3COOH) |
分析 A、100℃时,KW=10-12,此温度下PH=6的溶液中:c(H+)=c(OH-)=1×10-6mol/L,该溶液一定为中性;
B、25℃时,0.1mol/L的NaHSO3溶液pH=4,溶液显示酸性,只能说明HSO3-在水溶液中的电离程度大于其水解程度;
C、盐的水解对水的电离有促进作用;
D、根据溶液中物料守恒进行分析:n(CH3COO-)+n(CH3COOH)=0.001mol,n(Na+)=0.0005mol,所以同一溶液中2c(Na+)=c(CH3COO-)+c(CH3COOH).
解答 解:A、水的离子积KW=10-12,纯水中c(H+)=c(OH-)=1×10-6mol/L,此温度下PH=6,溶液显示中性,故A错误;
B、25℃时,0.1mol/L的NaHSO3溶液pH=4,只能说明HSO3-在水溶液中的电离程度大于亚硫酸氢根离子的水解程度,但无论是HSO3-的电离程度还是水解程度均非常小,故c(HSO3-)>c(SO32-),故B正确;
C、盐的水解对水的电离有促进作用,故NH4Cl、CH3COONa、NaHCO3均能促进水的电离,但NaHSO4不水解,且溶于水后能电离出大量的氢离子,对水的电离有抑制作用,故C错误;
D、溶液中n(CH3COO-)+n(CH3COOH)=0.001mol、n(Na+)=0.0005mol,则n(CH3COO-)+n(CH3COOH)=2n(Na+),由于在同一溶液中,所以2c(Na+)=c(CH3COO-)+c(CH3COOH),故D正确;
故选BD.
点评 本题考查了水的电离、盐的水解等知识,题目难度中等,注意判断溶液酸碱性时,要根据溶液中氢离子与氢氧根离子的浓度大小进行判断;选项D为易错点,注意物料守恒的应用.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
2.用括号中的试剂和方法除去各物质中的少量杂质,正确的是( )
| A. | 苯中的甲苯(溴水、分液) | B. | 乙醇中的乙酸(NaOH溶液,分液) | ||
| C. | 乙醇中的水(新制CaO,蒸馏) | D. | 乙酸乙酯中的乙酸(NaOH溶液,分液) |
9.下列叙述正确的是( )
| A. | 向溴水中滴入植物油,振荡后油层仍显无色,因此溴不溶于油脂 | |
| B. | FeCl3溶液可以腐蚀线路板上的Cu,因此Fe的金属活动性大于Cu | |
| C. | 常温下,2NO(g)+O2(g)=2NO2(g),因此该反应△H<0 | |
| D. | 相同浓度的Na2CO3溶液的碱性强于C6H5ONa,因此C6H5OH的酸性强于H2CO3 |
6.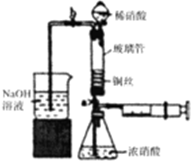 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3];
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状;
Ⅲ.按如图所示装置连接仪器,检查气密性,装入化学试剂.
(1)写出Cu丝在空气中形成铜绿的化学反应方程式2Cu+CO2+O2+H2O=Cu2(OH)2CO3;
(2)将铜丝烧成螺旋状的原因是增大铜丝与酸的接触面积,提高化学反应速率,写出过程Ⅲ中检查气密性的方法打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好;
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是产生红棕色气体,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开,关闭a,取下注射器;
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生,稀硝酸充满玻璃管的实验目的是将玻璃管中的NO2和空气排出,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致,结果如表所示(忽略温度对气体体积的影响):
①根据上表得出的结论是温度越低(填“高”或“低”),进入试管中的溶液越多;
②假设反应在标准状况下进行,小试管的容积为VL,将小试管倒立在盛有足量水的水槽中,若溶液溶质不扩散,则得到的溶液的物质的量浓度是$\frac{1}{22.4}$mol/L,若使液体充满试管,应该充入氧气的体积是$\frac{V}{4}$L.
 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3];
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状;
Ⅲ.按如图所示装置连接仪器,检查气密性,装入化学试剂.
(1)写出Cu丝在空气中形成铜绿的化学反应方程式2Cu+CO2+O2+H2O=Cu2(OH)2CO3;
(2)将铜丝烧成螺旋状的原因是增大铜丝与酸的接触面积,提高化学反应速率,写出过程Ⅲ中检查气密性的方法打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好;
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是产生红棕色气体,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开,关闭a,取下注射器;
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生,稀硝酸充满玻璃管的实验目的是将玻璃管中的NO2和空气排出,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致,结果如表所示(忽略温度对气体体积的影响):
| 实验编号 | 水温/℃ | 液面上升高度 |
| 1 | 25 | $\frac{2}{3}$ |
| 2 | 50 | 不足试管的$\frac{2}{3}$ |
| 3 | 0 | 液面上升超过实验1 |
②假设反应在标准状况下进行,小试管的容积为VL,将小试管倒立在盛有足量水的水槽中,若溶液溶质不扩散,则得到的溶液的物质的量浓度是$\frac{1}{22.4}$mol/L,若使液体充满试管,应该充入氧气的体积是$\frac{V}{4}$L.
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA |
7.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )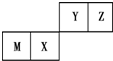

| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | Z位于元素周期表中第2周期第ⅥA族 |
8.下列反应中不属于加成反应的是( )
| A. | 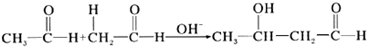 | |
| B. | CH2=CH-CH=CH2+2H2$→_{△}^{催化剂}$CH3-CH2-CH-CH3 | |
| C. | 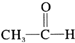 +H2$→_{△}^{催化剂}$CH3-CH-OH +H2$→_{△}^{催化剂}$CH3-CH-OH | |
| D. | CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr |
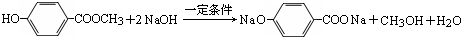 .
.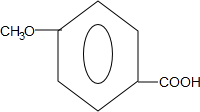 .
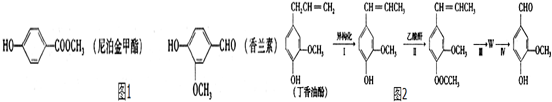
. 和ClCH2CH═CH2 合成丁香油酚的反应类型为取代反应.
和ClCH2CH═CH2 合成丁香油酚的反应类型为取代反应.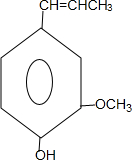 +CH3OCOCOCH3→
+CH3OCOCOCH3→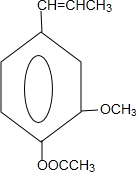 +CH3COOH.
+CH3COOH.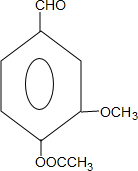 _.
_.
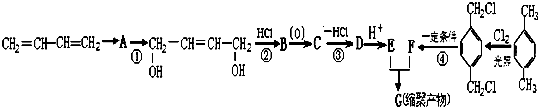
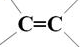 、-COOH.
、-COOH.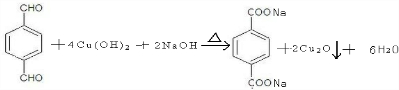 ;
;  .
.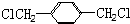 的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.
的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.