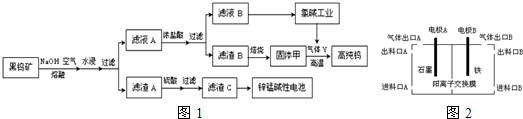
题目内容
11.在室温下,下列各组微粒在溶液中能大量共存的是( )| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、C6H5O-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应,不能结合生成络离子,不能发生相互促进水解反应等,则离子大量共存,以此来解答.
解答 解:A.该组离子之间不反应,可大量共存,故A选;
B.H+、Fe2+、ClO-发生氧化还原反应,不能大量共存,故B不选;
C.Fe3+分别与C6H5O-、SCN-结合生成络离子,不能大量共存,故C不选;
D.Al3+分别与SiO32-、CO32-相互促进水解,不能大量共存,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重氧化还原反应、络合反应、水解反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
15.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 含0.1 mol BaCl2的溶液中Cl-数为0.1NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 11.2 L CO2所含有的分子数为0.5NA | |
| D. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g |
6.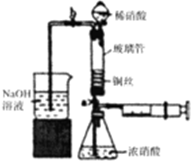 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3];
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状;
Ⅲ.按如图所示装置连接仪器,检查气密性,装入化学试剂.
(1)写出Cu丝在空气中形成铜绿的化学反应方程式2Cu+CO2+O2+H2O=Cu2(OH)2CO3;
(2)将铜丝烧成螺旋状的原因是增大铜丝与酸的接触面积,提高化学反应速率,写出过程Ⅲ中检查气密性的方法打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好;
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是产生红棕色气体,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开,关闭a,取下注射器;
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生,稀硝酸充满玻璃管的实验目的是将玻璃管中的NO2和空气排出,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致,结果如表所示(忽略温度对气体体积的影响):
①根据上表得出的结论是温度越低(填“高”或“低”),进入试管中的溶液越多;
②假设反应在标准状况下进行,小试管的容积为VL,将小试管倒立在盛有足量水的水槽中,若溶液溶质不扩散,则得到的溶液的物质的量浓度是$\frac{1}{22.4}$mol/L,若使液体充满试管,应该充入氧气的体积是$\frac{V}{4}$L.
 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3];
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状;
Ⅲ.按如图所示装置连接仪器,检查气密性,装入化学试剂.
(1)写出Cu丝在空气中形成铜绿的化学反应方程式2Cu+CO2+O2+H2O=Cu2(OH)2CO3;
(2)将铜丝烧成螺旋状的原因是增大铜丝与酸的接触面积,提高化学反应速率,写出过程Ⅲ中检查气密性的方法打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好;
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是产生红棕色气体,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开,关闭a,取下注射器;
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生,稀硝酸充满玻璃管的实验目的是将玻璃管中的NO2和空气排出,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致,结果如表所示(忽略温度对气体体积的影响):
| 实验编号 | 水温/℃ | 液面上升高度 |
| 1 | 25 | $\frac{2}{3}$ |
| 2 | 50 | 不足试管的$\frac{2}{3}$ |
| 3 | 0 | 液面上升超过实验1 |
②假设反应在标准状况下进行,小试管的容积为VL,将小试管倒立在盛有足量水的水槽中,若溶液溶质不扩散,则得到的溶液的物质的量浓度是$\frac{1}{22.4}$mol/L,若使液体充满试管,应该充入氧气的体积是$\frac{V}{4}$L.
16.水溶液中能大量共存的一组离子是( )
| A. | K+、Al3+、NO3-、HCO3- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、SO42-、OH- |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA |
20.下列说法正确的是( )
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)只能在高温下自发进行,则该反应△H>0 | |
| B. | 电镀时,镀层金属跟直流电源的负极相连 | |
| C. | 锅炉内壁上沉积的CaSO4可先用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | 向100 mL纯水中滴加1 mL浓硫酸,水的离子积常数Kw减小 |
1.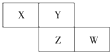 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的弱 | |
| D. | X与Y形成的化合物都易溶于水 |