题目内容
4.A、B、C、D、E是中学化学中五种常见元素,有关信息如下:| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子式是NH3,用电子式表示该物质的形成过程为:
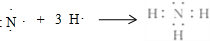 .写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(2)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
(3)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:①③ ①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏.
分析 A的氢化物水溶液呈碱性,则A为N元素;B是地壳中含量最多的元素,则B为O元素;C的单质须保存在煤油中,则C为Na;D单质与NaOH溶液反应可用于生产漂白液,则D为Cl;E单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe,据此解答.
解答 解:A的氢化物水溶液呈碱性,则A为N元素;B是地壳中含量最多的元素,则B为O元素;C的单质须保存在煤油中,则C为Na;D单质与NaOH溶液反应可用于生产漂白液,则D为Cl;E单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe.
(1)A的氢化物分子式是NH3,用电子式表示该物质的形成过程为: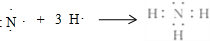 .实验室制取该物质的化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
.实验室制取该物质的化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:NH3;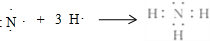 ;Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
;Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)A、D的氢化物相互反应,产生白色固体为2NH4Cl,对该固体中阳离子存在检验的操作方法是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),
故答案为:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生);
(3)A与B可组成质量比为7:16的三原子分子,N、O原子数目之比为$\frac{7}{14}$:$\frac{16}{16}$=1:2,该分子为NO2,可引起酸雨和光化学烟雾,故答案为:①③.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对基础知识的巩固,注意掌握电子式表示物质或化学键的形成.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 水 | B. | 烧碱溶液 | C. | AgNO3溶液 | D. | 新制Cu(OH)2 |
| A. | 将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照 | |
| B. | 不能使无色酚酞试液变色的溶液是酸性溶液 | |
| C. | 可以用紫色石蕊试液作为强酸滴定强碱的指示剂 | |
| D. | 用pH试纸测定某溶液的pH=8.5,此溶液一定是某种碱的溶液 |
| A. | 在此反应中硝酸体现强氧化性,全部被还原 | |
| B. | 向反应后的溶液中再加入金属铁,不再发生化学反应 | |
| C. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:4 | |
| D. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:5 |
| A. |  2,4-二甲基己烷 2,4-二甲基己烷 | |
| B. |  2-甲基-4-戊炔 2-甲基-4-戊炔 | |
| C. |  3-甲基-2-丁醇 3-甲基-2-丁醇 | |
| D. | CH3-CHBr-CHBr-CH3 2,3-二溴丁烷 |
| A. | S2- | B. | Ca2+ | C. | F- | D. | Cl- |
| A. | 非金属元素原子组成的化合物不可能是离子化合物 | |
| B. | ⅠA族元素的金属性一定比ⅡA族元素的金属性强 | |
| C. | 同一主族元素组成的化合物一定是共价化合物 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1 mol NH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
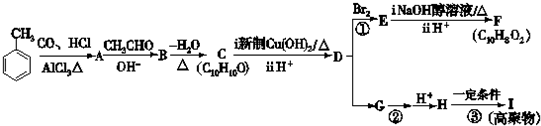
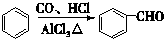
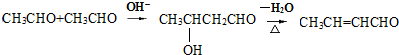
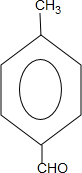 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O. .
.