题目内容
13.下列各离子的核外电子排布与Ar原子不相同的是( )| A. | S2- | B. | Ca2+ | C. | F- | D. | Cl- |
分析 与氩原子核外电子排布相同的离子有P3-、S2-、Cl-、K+、Ca2+,据此分析解答.
解答 解:与氩原子核外电子排布相同的离子有P3-、S2-、Cl-、K+、Ca2+,
A.S2-和Ar原子核外电子排布式相同,所以符合条件,故A正确;
B.Ca2+和Ar原子核外电子排布式相同,所以符合条件,故B正确;
C.F-与Ne原子核外电子排布式相同,不符合条件,故C错误;
D.Cl-Ar原子核外电子排布式相同,符合条件,故D正确;
故选C
点评 本题考查了离子核外电子排布式,明确形成18电子简单离子有哪些是解本题关键,根据离子是否符合题意即可,题目难度不大.

练习册系列答案
相关题目
4.A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
请回答下列问题:
(1)A的氢化物分子式是NH3,用电子式表示该物质的形成过程为: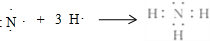 .写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
(3)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:①③ ①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏.
| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子式是NH3,用电子式表示该物质的形成过程为:
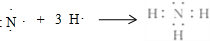 .写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(2)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
(3)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:①③ ①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏.
1.环癸五烯的结构简式可表示为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 根据 的结构特点可知环癸五烯的分子式为C10H8 的结构特点可知环癸五烯的分子式为C10H8 | |
| B. | 常温常压下环癸五烯是一种易溶于水的无色气体 | |
| C. | 环癸五烯既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| D. | 乙烯和环癸五烯互为同系物 |
18.有pH值相等的A、B、C、D四种一元酸的溶液各20mL,与过量镁充分反应后,产生氢气质量是D>C>B=A.
这说明:①D的酸性最强.
②A与B的酸性最强且彼此相当.
③原D反应后溶液的pH值最大.
④反应后原A和B的溶液的pH值最大;
⑤反应前D的电离程度最大,
⑥反应前四种酸的电离程度相同,其中正确的是( )
这说明:①D的酸性最强.
②A与B的酸性最强且彼此相当.
③原D反应后溶液的pH值最大.
④反应后原A和B的溶液的pH值最大;
⑤反应前D的电离程度最大,
⑥反应前四种酸的电离程度相同,其中正确的是( )
| A. | ①③⑤ | B. | ②④⑥ | C. | ①⑥ | D. | ②③ |
5.将等物质的量的X、Y气体充入一容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)???2M(s)+2Z(g)△H<0.若改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
| 改变的条件 | 正、逆反应速率变化 | 新平衡与原平衡比较 | |
| A | 升高温度 | 逆反应速率增大量大于正反应速率增大量 | X的体积分数增大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入一定 量的Z | 逆反应速率增大 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
2.碳酸钠(Na2CO3)俗称纯碱,是一种重要的基础化工原料,广泛应用于玻璃、造纸等工业.下列与碳酸钠有关的说法正确的是( )
| A. | Na2CO3的稳定性介于Na2CO3•10H2O和NaHCO3之间 | |
| B. | “侯氏制碱法”制得的碱是指NaHCO3 | |
| C. | 可用盐酸鉴别Na2CO3 和NaHCO3固体 | |
| D. | 纯碱有时可代替烧碱使用,比如溶解石英、吸收氯气等 |
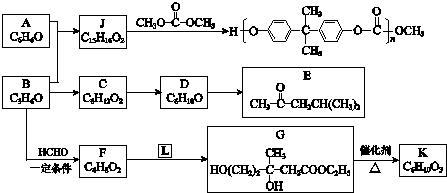
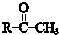 +
+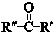 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$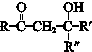 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基) .
. .
. .F和L反应生成G是加成反应,L的结构简式CH3COOCH2CH3.
.F和L反应生成G是加成反应,L的结构简式CH3COOCH2CH3. .
. .
.
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O; 卤素的单质及其化合物在生产、生活中应用广泛.
卤素的单质及其化合物在生产、生活中应用广泛. (如${\;}_{1}^{2}$H).
(如${\;}_{1}^{2}$H).