题目内容
19.物质的量之比为1:3的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是( )| A. | 在此反应中硝酸体现强氧化性,全部被还原 | |
| B. | 向反应后的溶液中再加入金属铁,不再发生化学反应 | |
| C. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:4 | |
| D. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:5 |
分析 物质的量之比为1:3的锌与稀硝酸反应,设Zn的物质的量为1mol则硝酸的物质的量为3mol,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,锌完全溶解转移电子物质的量=1mol×(2-0)=2mol,根据转移电子相等生成n(N2O)=$\frac{2mol}{(5-1)×2}$=0.25mol,根据N原子守恒得作氧化剂硝酸的物质的量=2n(N2O)=2×0.25mol=0.5mol,起酸作用硝酸物质的量=2n[Zn(NO3)2]=2×1mol=2mol,所以消耗总的硝酸物质的量=0.5mol+2mol=2.5mol<3mol,则硝酸有剩余,据此分析解答.
解答 解:物质的量之比为1:3的锌与稀硝酸反应,设Zn的物质的量为1mol则硝酸的物质的量为3mol,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,锌完全溶解转移电子物质的量=1mol×(2-0)=2mol,根据转移电子相等生成n(N2O)=$\frac{2mol}{(5-1)×2}$=0.25mol,根据N原子守恒得作氧化剂硝酸的物质的量=2n(N2O)=2×0.25mol=0.5mol,起酸作用硝酸物质的量=2n[Zn(NO3)2]=2×1mol=2mol,所以消耗总的硝酸物质的量=0.5mol+2mol=2.5mol<3mol,则硝酸有剩余,
A.根据以上分析知,在此反应中硝酸体现强氧化性、酸性,部分被还原,故A错误;
B.硝酸有剩余,所以向反应后的溶液中再加入金属铁,会发生化学反应,故B错误;
C.被还原硝酸的物质的量是0.5mol,未被还原硝酸的物质的量=3mol-0.5mol=2.5mol,所以该反应中被还原的硝酸与未被还原的硝酸之比=0.5mol:2.5mol=1:5,故C错误;
D.根据C知,该反应中被还原的硝酸与未被还原的硝酸之比为1:5,故D正确;
故选D.
点评 本题以锌和稀硝酸的反应为载体考查氧化还原反应方程式的有关计算,正确判断溶液中的溶质是解本题关键,易错选项是CD,注意未被还原的硝酸还包含没有反应的硝酸,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. |  | B. |  | C. |  | D. | C6H12 |
| A. | 澄清石灰水、浓H2SO4 | B. | KMnO4(H+)、浓H2SO4 | ||
| C. | 溴水、NaOH溶液、浓H2SO4 | D. | 浓H2SO4、KMnO4(H+)、NaOH溶液 |
| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子式是NH3,用电子式表示该物质的形成过程为:
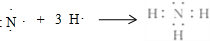 .写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(2)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
(3)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:①③ ①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏.
| A. | 我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| B. | 只要符合限量,“食用色素”“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂 | |
| C. | 氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
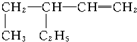 名称:3-乙基-1-戊烯.
名称:3-乙基-1-戊烯. 名称:5-甲基-2-己烯.
名称:5-甲基-2-己烯. 名称:5-甲基-3-庚炔.
名称:5-甲基-3-庚炔.
 .
. .
.
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;