题目内容
15.已知常温下0.01mol•L-1 H2SO4(强酸)溶液中c(H+)=0.011mol•L-1,回答下列问题.(1)NaHSO4溶液中各微粒浓度由大到小的顺序为c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-),Na2SO4溶液呈碱性性(填“酸”、“碱”或“中”),原因是SO42-+H2O?OH-+HSO4-(用离子方程式表示).
(2)常温下,0.01mol•L-1的NaHSO4溶液中c(H+)>0.001mol•L-1(填“>”、“<”或“=”).
(3)2mol•L-1 NaHSO4溶液与1mol•L-1 Ba(OH)2溶液等体积混合,反应的离子方程式为2OH-+2HSO4-+Ba2+=BaSO4↓+2H2O+SO42-.若继续滴加Ba(OH)2溶液,反应的离子方程式为SO42-+Ba2+=BaSO4↓.
分析 常温下0.01mol•L-1 H2SO4(强酸)溶液中c(H+)=0.011mol•L-1,说明硫酸的第二步电离存在电离平衡,
(1)NaHSO4溶液中,硫酸氢根离子的电离程度大于其水解程度,溶液显示酸性,据此判断各离子浓度大小;硫酸钠溶液中,硫酸根离子部分水解生成硫酸氢根离子,溶液显示碱性,据此写出其水解方程式;
(2)硫酸的第一步电离抑制了其第二步电离,导致硫酸中硫酸氢根离子的电离程度减小,据此判断0.01mol/L的硫酸氢钠溶液中氢离子浓度大小;
(3)硫酸氢钠与氢氧化钡反应生成硫酸钡和水,其中硫酸氢钠不能拆开,硫酸根离子过量;继续滴加氢氧化钡,剩余的硫酸根离子与钡离子反应生成硫酸钡沉淀.
解答 解:常温下0.01mol•L-1 H2SO4(强酸)溶液中c(H+)=0.011mol•L-1,说明第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-?H++SO42-,
(1)NaHSO4溶液中,硫酸氢根离子的电离程度大于其水解程度,溶液显示酸性,则c(H+)>c(OH-)、c(Na+)>c(HSO4-),溶液中离子浓度大小为:c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-);
Na2SO4溶液中硫酸根离子易水解,所以溶液中存在水解平衡:SO42-+H2O?OH-+HSO4-,导致溶液呈弱碱性,
故答案为:c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-);碱;SO42-+H2O?OH-+HSO4-;
(2)0.01mol•L-1 H2SO4(强酸)溶液中c(H+)=0.011mol•L-1,硫酸的第一步电离的氢离子浓度为0.01mol/L,则第二步电离出的氢离子为0.001mol/L,硫酸的第一步电离出的氢离子抑制第二步电离,所以0.01mol/L的硫酸氢钠溶液中,氢离子浓度应该大于0.001mol/L,
故答案为:>;
(3)2mol•L-1 NaHSO4溶液与1mol•L-1 Ba(OH)2溶液等体积混合,反应后硫酸根离子过量,反应的离子方程式为:2OH-+2HSO4-+Ba2+=BaSO4↓+2H2O+SO42-;若继续滴加Ba(OH)2溶液,钡离子与硫酸根离子反应生成硫酸钡沉淀,离子方程式为:SO42-+Ba2+=BaSO4↓,
故答案为:2OH-+2HSO4-+Ba2+=BaSO4↓+2H2O+SO42-;SO42-+Ba2+=BaSO4↓.
点评 本题考查了离子浓度大小比较、盐的水解原理及其应用,题目难度中等,明确硫酸的第二步部分电离为解答关键,注意掌握判断离子浓度大小常用方法,试题侧重考查学生的分析、理解能力.

| A. | 1 | B. | 0.8 | C. | $\frac{1}{22.4}$ | D. | $\frac{1}{28}$ |
| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子式是NH3,用电子式表示该物质的形成过程为:
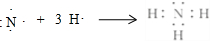 .写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(2)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
(3)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:①③ ①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏.
| 改变的条件 | 正、逆反应速率变化 | 新平衡与原平衡比较 | |
| A | 升高温度 | 逆反应速率增大量大于正反应速率增大量 | X的体积分数增大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入一定 量的Z | 逆反应速率增大 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
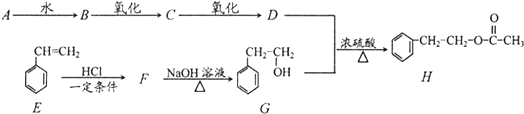
 .
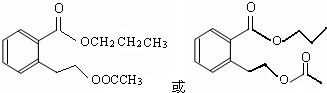
.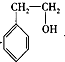 +CH3COOH$?_{△}^{浓硫酸}$
+CH3COOH$?_{△}^{浓硫酸}$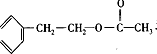 +H2O.
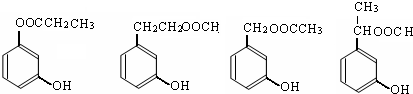
+H2O.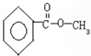 、、
、、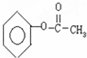 、
、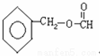 .
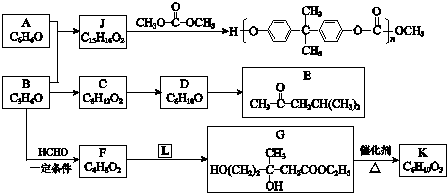
.
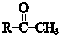 +
+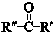 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$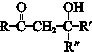 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基)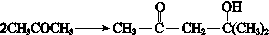 .
.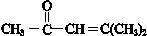 .
.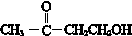 .F和L反应生成G是加成反应,L的结构简式CH3COOCH2CH3.
.F和L反应生成G是加成反应,L的结构简式CH3COOCH2CH3.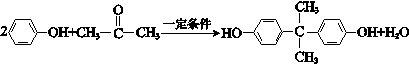 .
.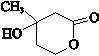 .
.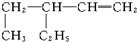 名称:3-乙基-1-戊烯.
名称:3-乙基-1-戊烯.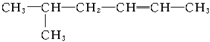 名称:5-甲基-2-己烯.
名称:5-甲基-2-己烯.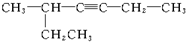 名称:5-甲基-3-庚炔.
名称:5-甲基-3-庚炔.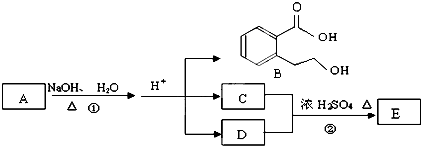
 .
. .
.