题目内容
14.区别乙醛、苯、溴最好选用的是( )| A. | 水 | B. | 烧碱溶液 | C. | AgNO3溶液 | D. | 新制Cu(OH)2 |
分析 利用三者的水溶性以及密度大小可进行鉴别,为最简单的方法,以此解答.
解答 解:A.乙醛易溶于水,苯不溶于水,溴本身为红棕色,加入水时,现象各不相同,可鉴别,为最简单的方法,故A选;
B.烧碱溶液不能鉴别乙醛、溴,均得到无色溶液,故B不选;
C.乙醛与硝酸银不反应不分层、苯与硝酸银不反应分层,溴与硝酸银反应生成浅黄色沉淀,可鉴别,但硝酸银比水价格昂贵,故C不选;
D.乙醛与新制Cu(OH)2反应需要加热、苯与新制Cu(OH)2不反应分层,溴与新制Cu(OH)2不反应,现象不同,可鉴别,但操作较复杂,故D不选;
故选A.
点评 本题考查物质的检验和鉴别,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同为解答该题的关键,题目难度不大.

练习册系列答案
相关题目
5.标准状况下,将NO2和O2按4:1体积比充满一烧瓶,烧瓶倒置于水中待液面稳定(假设溶质不向外扩散),则烧瓶内溶液的物质的量浓度为(mol/L)( )
| A. | 1 | B. | 0.8 | C. | $\frac{1}{22.4}$ | D. | $\frac{1}{28}$ |
2.下列关于反应热的说法不正确的是( )
| A. | 已知下列热化学方程式:2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1,则氢气的燃烧热为242kJ•mol-1 | |
| B. | 中和反应的实质是H+ 与OH-结合生成水,若有其它物质生成,这部分反应热不在中和热内 | |
| C. | 物质的燃烧热可利用仪器由实验测得 | |
| D. | 中和热不包括物质溶解、电离、水合等过程中的热效应 |
9.下列物质中,一定能使KMnO4酸性溶液和溴水都因发生化学反应而褪色的是( )
| A. |  | B. |  | C. |  | D. | C6H12 |
4.A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
请回答下列问题:
(1)A的氢化物分子式是NH3,用电子式表示该物质的形成过程为: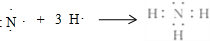 .写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
(3)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:①③ ①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏.
| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子式是NH3,用电子式表示该物质的形成过程为:
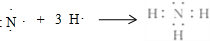 .写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(2)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
(3)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:①③ ①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏.

 .
.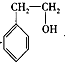 +CH3COOH$?_{△}^{浓硫酸}$
+CH3COOH$?_{△}^{浓硫酸}$ +H2O.
+H2O. 、、
、、 、
、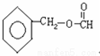 .
.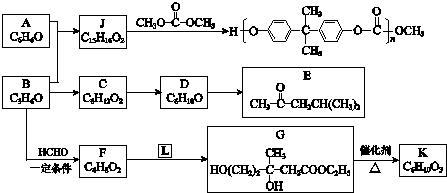
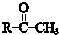 +
+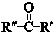 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$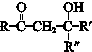 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基) .
. .
. .F和L反应生成G是加成反应,L的结构简式CH3COOCH2CH3.
.F和L反应生成G是加成反应,L的结构简式CH3COOCH2CH3. .
. .
.