题目内容
18.CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题.(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为2CO+O2+4OH-=2CO32-+2H2O.
②用CO、O2和固体电解质还可以制成如图1所示的燃料电池,则电极d的电极反应式为CO+O2--2e-=CO2.
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示.
①在图示的转化中,化合价不变的元素是氢、钠(填元素名称).
②在转化过程中通入氧气发生反应后,溶液的pH将增大(填“增大”、“减小”或“不变”).转化中当有1mol N2H4参与反应时,需要消耗O2的物质的量为1mol.
③加入NaClO时发生的反应为:Cu(NH3)42++2ClO-+2OH-═Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有氢氧化铜分解、降低联氨溶解度使其从溶液中逸出.
(3)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:4CO+2SO2=4CO2+S2.
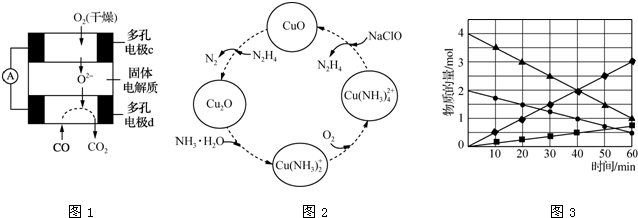
分析 (1)①该燃料电池中,负极上CO失电子发生氧化反应,正极上氧气得电子发生还原反应;
②该燃料电池中,负极上CO失电子和氧离子反应生成二氧化碳,正极上氧气得电子生成氧离子;
(2)①该反应中H、Na元素都是在化合物,化合价不变;
②Cu(NH3)2+ 和氧气反应过程中,Cu元素化合价由+1价变为+2价,O元素化合价由0价变为-2价,氧气得电子和水反应生成氢氧根离子;根据转移电子守恒计算消耗氧气的量;
③温度高时氢氧化铜分解,且气体溶解度随温度升高而降低;
(3)根据图象知,反应物的物质的量变化量一个为(4-1)mol=3mol、一个为(2-0.5)mol=1.5mol,生成物的物质的量变化量一个为(3-0)mol=3mol、一个为(0.75-0)mol=0.75mol,则反应物、生成物的物质的量变化量之比等于其计量数之比=3mol:1.5mol:3mol:0.75mol=4:2:4:1,根据C原子守恒知,计量数是4的为CO、CO2,二氧化硫的计量数是2,硫单质的计量数是1,则生成的硫单质为S2,根据反应物、生成物书写方程式.
解答 解:(1)①该燃料电池中,负极上CO失电子发生氧化反应生成二氧化碳,正极上氧气得电子发生还原反应生成氢氧根离子,二氧化碳和氢氧根离子反应生成碳酸根离子和水,所以电池反应式为2CO+O2+4 OH-=2 CO32-+2H2O,故答案为:2CO+O2+4 OH-=2 CO32-+2H2O;
②d电极上CO生成二氧化碳,则该电极上失电子发生氧化反应,电极反应式为CO+O2--2e-=CO2,
故答案为:CO+O2--2e-=CO2;
(2)根据图知,H、Na元素都在化合物中,化合价不变,故答案为:氢、钠;
②Cu(NH3)2+ 和氧气反应过程中,Cu元素化合价由+1价变为+2价,O元素化合价由0价变为-2价,氧气得电子和水反应生成氢氧根离子,所以溶液的pH增大;
转化中当有1mol N2H4参与反应时,转移电子物质的量=1mol×2×[0-(-2)]=4mol,根据转移电子相等得需要消耗O2的物质的量=4mol4=1mol,
故答案为:增大;1mol;
③温度高时氢氧化铜分解,且气体溶解度随温度升高而降低,从而促进反应向正反应方向进行,
故答案为:氢氧化铜分解、降低联氨溶解度使其从溶液中逸出;
(3)根据图象知,反应物的物质的量变化量一个为(4-1)mol=3mol、一个为(2-0.5)mol=1.5mol,生成物的物质的量变化量一个为(3-0)mol=3mol、一个为(0.75-0)mol=0.75mol,则反应物、生成物的物质的量变化量之比等于其计量数之比=3mol:1.5mol:3mol:0.75mol=4:2:4:1,根据C原子守恒知,计量数是4的为CO、CO2,二氧化硫的计量数是2,硫单质的计量数是1,则生成的硫单质为S2,所以反应方程式为4CO+2SO2=4CO2+S2,故答案为:4CO+2SO2=4CO2+S2.
点评 本题考查原电池原理、氧化还原反应、化学方程式计算等知识点,为高频考点,结合电解质溶液书写电极反应式,难点是(3)题生成物硫化学式的确定,明确计量数与物质的量变化量关系是解(3)题关键,题目难度中等.

| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有沉淀产生 | 蛋白质均发生变性 |
| D | 向某溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
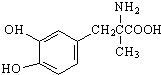
| A. | 1 mol甲基多巴的分子中含有4 mol双键 | |
| B. | 每个甲基多巴分子中含有一个手性碳原子 | |
| C. | 1 mol甲基多巴最多能与2 mol Br2发生取代反应 | |
| D. | 甲基多巴既能与盐酸反应,又能与氢氧化钠溶液反应 |
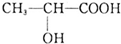 ,下列有关乳酸的说法中,不正确的是( )
,下列有关乳酸的说法中,不正确的是( )| A. | 乳酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol乳酸可与2 mol NaOH发生中和反应 | |
| C. | 1 mol乳酸与足量金属Na反应生成1 mol H2 | |
| D. | 有机物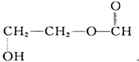 与乳酸互为同分异构体 与乳酸互为同分异构体 |

下列有关说法正确的是( )
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
 .
.
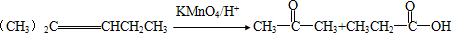

 ;D
;D
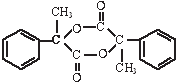 )是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图:
)是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如图: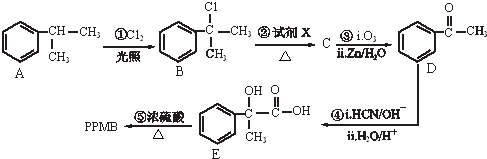
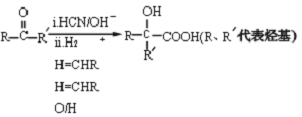
 .
. .
.