题目内容
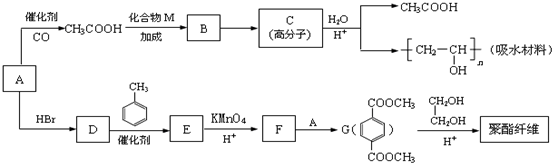
7.一种类似有机玻璃塑料-聚丁烯酸甲酯,它有广泛的用途.合成这种塑料有不是同途径,以下合成途径中的副产品大多为低污染物,原子利用率较高,因此符合“绿色化学”的要求,其反应器流程如下: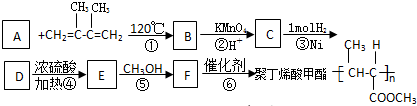
①
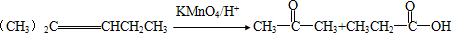
②CH2═CH-CH═CH2+CH≡CH$\frac{\underline{\;高于100℃\;}}{\;}$

请回答下列问题:
(1)B、D的结构简式为:B
 ;D
;D
(2)此合成途径是的化学反应类型:②氧化反应,④消去反应
(3)写出E的两种羧酸类的同分异构体的结构简式:CH2=C(CH3)COOH;CH2=CHCH2COOH
(4)写出反应⑤的化学方程式CH3CH=CHCOOH+CH3OH$→_{△}^{浓硫酸}$CH3CH=CHCOOCH3+H2O
(5)在绿色化学工艺中理想状态是反应物原子全部转化为所制得的产物,即原子利用率为100%,上述合成过程中符合这一反应要求的是①③⑥.
分析 由聚丁烯酸甲酯结构可知F为CH3CH=CHCOOCH3,逆推可知E为CH3CH=CHCOOH,结合转化关系可知,B中不饱和键被氧化得到C,而1molC能与1氢气发生加成反应,故C中含有羰基,由E的结构可知,故D为 ,C为
,C为 ,可知B为
,可知B为 ,则A为CH≡CH,结合有机物的结构和性质可解答该题.
,则A为CH≡CH,结合有机物的结构和性质可解答该题.
解答 解:由聚丁烯酸甲酯结构可知F为CH3CH=CHCOOCH3,逆推可知E为CH3CH=CHCOOH,结合转化关系可知,B中不饱和键被氧化得到C,而1molC能与1氢气发生加成反应,故C中含有羰基,由E的结构可知,故D为 ,C为
,C为 ,可知B为
,可知B为 ,则A为CH≡CH.
,则A为CH≡CH.
(1)由以上分析可知,B为 ,D为
,D为 ,
,
故答案为: ;
; ;
;
(2)反应②的条件为酸性高锰酸钾,应为氧化反应,反应④为 在浓硫酸作用下发生消去反应,
在浓硫酸作用下发生消去反应,
故答案为:氧化反应,消去反应;
(3)E为CH3CH=CHCOOH,对应的同分异构体有CH2=C(CH3)COOH、CH2=CHCH2COOH、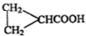 等,
等,
故答案为:CH2=C(CH3)COOH、CH2=CHCH2COOH、 (任写2个);
(任写2个);
(4)反应⑤为 与甲醇的酯化反应,
与甲醇的酯化反应,
反应的方程式为CH3CH=CHCOOH+CH3OH$→_{△}^{浓硫酸}$CH3CH=CHCOOCH3+H2O,
故答案为:CH3CH=CHCOOH+CH3OH$→_{△}^{浓硫酸}$CH3CH=CHCOOCH3+H2O;
(5)反应原子利用率最高的化学反应应为加成或加聚反应,有①③⑥,故答案为:①③⑥.
点评 本题考查有机物的推断,题目难度中等,注意由聚丁烯酸甲酯结构结合反应信息利用逆推法推断,注意掌握有机物的官能团的性质.

练习册系列答案
相关题目
17.设NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 25℃时,pH=13的1LBa(OH)2溶液中含有OH-数目为0.2NA | |
| B. | 标准状况下,1.12LNO与1.12LO2的混合物中含有的原子数为0.2NA | |
| C. | 常温下,4.6g乙醇含有C-H键总数为0.6NA | |
| D. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氧原子数为0.3NA |
15.下列反应的离子方程式正确的是( )
| A. | 过氧化钠固体与水反应制氧气:2O22-+2H2O=4OH-+O2↑ | |
| B. | 在100ml浓度为1 mol•L-1 的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 1mo•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+=Al(OH)3↓+Al3++H2 O | |
| D. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- |
2.在复杂体系中,确定化学反应的先后顺序有利于解决问题,对下列各种操作所涉及的反应先后顺序的判断合理的是( )
| A. | 向含有等物质的量的Ba(OH)2、KOH、的混合溶液中通入CO2;与CO2反应的物质依次是KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物质的量的Fe2+、Ag+、Cu2+ 的混合溶液中加入Zn:与Zn反应的离子依次是Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物质的量的AlO2?、OH-、CO32- 的混合溶液中滴加盐酸:与盐酸反应的物质依次是AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 向含有等物质的量的AlCl3、HCl的混合溶液中滴加NaOH溶液,与NaOH反应的物质依次是AlCl3、HCl、Al(OH)3 |
12.下列使用漏斗的几个实验装置中,设计正确且能达到实验目的是( )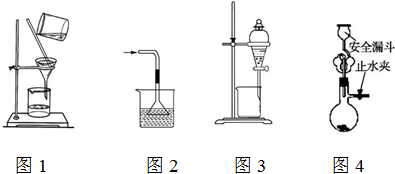

| A. | 用图1所示装置进行过滤,过滤时不断搅拌 | |
| B. | 用图2所示装置吸收NH3制氨水 | |
| C. | 用图3所示装置用苯萃取碘水中的碘,并将碘的苯溶液从漏斗下口放出 | |
| D. | 用图4所示装置用石灰石与稀盐酸制取CO2气体 |
17.已知:H-H、N-H、N≡N的键能分别为436KJ/mol,391KJ/mol,946KJ/mol,则:1molH2(g)与足量氮气完全反应生成NH3(g)的反应热△H(KJ/mol)为( )
| A. | +30.67 | B. | -345.3 | C. | -30.67 | D. | +345.3 |
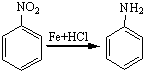
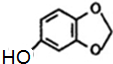 ;A的名称(系统命名)是1,2,4-苯三酚.
;A的名称(系统命名)是1,2,4-苯三酚.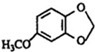 +HNO3(浓)$\stackrel{0℃-5℃}{→}$
+HNO3(浓)$\stackrel{0℃-5℃}{→}$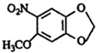 +H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.
+H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.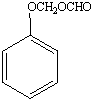 .
.
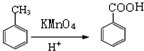
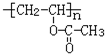 ,M的结构简式是HC≡CH,
,M的结构简式是HC≡CH,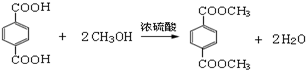 .
.