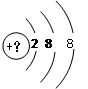题目内容
(14分)现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素。X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5。
(1)R元素在周期表中的位置 ;W2X2的电子式 。
(2)X、Y、Z的最低价氢化物中:沸点最高的是 (填化学式);共价键键能最小的是 ;X、Y、Z的杂化类型 (填相同或不相同)。
(3)若R的晶体中每个晶胞平均含有2个R原子,请在下图晶胞中用?标出未画出的R原子。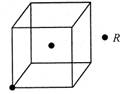
(4)将1.19g ZXY2溶于100ml水中发生非氧化还原反应,生成2种酸,反应方程式为 ;所得溶液中阴离子浓度由大到小的顺序是 。
(14分)
(1)第四周期VIIB (2分)
(2)H2O(1分) H2S(1分) 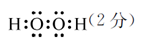 相同(2分)
相同(2分)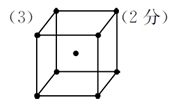
(4)SOCl2+2H2O=2HCl+H2SO3(2分)
c(Cl?) > c(HSO3?) > c(SO32?) > c(OH?) (2分)
解析试题分析:X原子的最外层电子数是核外电子层数的3倍,则X为O元素;X、Z同主族,且为短周期元素,则Z为S元素;Y的最高正价与最低负价的代数和为6,则Y为Cl元素;W与X、Y均不同周期,W为H元素;R2+的价电子排布式为3d5,故R为Mn元素。
(1)R为Mn元素,原子序数为25,在周期表中位于第四周期VIIB;W2X2为H2O2电子式为: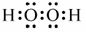
(2)X、Y、Z的最低价氢化物分别为H2O、HCl、H2S,因为H2O分子间能形成氢键,作用力更强,所以H2O的沸点最高;O、Cl、S元素非金属性最弱的是S元素,所以H2S共价键键能最小;O、Cl、S的杂化类型都是sp3杂化,杂化类型相同。
(3)每个晶胞平均含有2个R原子,图中已标出的原子位于体心,则未标出的R原子应在立方体的8个顶点上。
(4)ZXY2为SOCl2与水发生非氧化还原反应,生成2种酸为HCl和H2SO3,所以化学方程式为:SOCl2+2H2O=2HCl+H2SO3;H2SO3为中强酸,第一步电离大于第二步电离,所以阴离子浓度由大到小的顺序是:c(Cl?) > c(HSO3?) > c(SO32?) > c(OH?)
考点:本题考查元素的推断、电子式的书写、元素周期律、杂化类型、晶胞的分析、化学方程式的书写。

A、B、C、D、E、F周表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| A | A是周期表中原子半径最小的元素 |
| B | B元素的原子价电子排布为ns11np14 |
| C | M的基态原子L层电子数是K层电子数的3倍 |
| D | D是第三周期中第一电离能最小的元素 |
| E | E是地壳中含量最多的金属元素 |
| F | 有多种化合价,其某种高价阳离子的价电子具有较稳定的半充满结构 |
(1)F位于元素周期表中位置 ,其基态原子核外价电子排布式为 ;
(2)B的电负性比M的 (填“大”或“小”);B2A3分子中
 键与
键与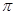 键与个数之比为 ;
键与个数之比为 ;(3)写出E的单质与D的最高价氧化物的水化物溶液反应的化学方程式: ;
(4)已知每5.4gE可与最低价F的氧化物反应,放出346.2kJ的热量。则请写出该反应的热化学方程式: 。
下表为元素周期表的一部分。请回答下列问题:
根据元素在周期表中的相对位置可知①~⑩分别是H、C、N、O、Mg、Al、Cl、Ca、Mn、Fe。
(1)上述元素中,属于s区的是____________(填元素符号)。
(2)写出元素④的基态原子的价电子排布图____________________。
(3)元素第一电离能为⑨________⑩ (填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为________;该分子为________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_____________________________。
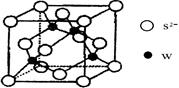
(5)⑥单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为 ,该晶体的密度为 (用字母表示)
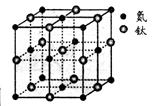
(6)实验证明:⑤和⑧的氧化物、KCl、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: (用化学式填写)。
其中⑧的氧化物晶体中一个阳离子周围和它最邻近且等距离的阳离子有 个。
下列各元素的原子在形成不同物质时,既能形成非极性键,也能形成极性键,还能形成离子键的是( )。
| A.Na | B.Fe | C.C | D.Ne |