题目内容
37.(15分) (1)1:2(1分) O<N<F(1分)
(2)3d64s2 (1分) CO2(CS2 N2O)等合理答案都可以(1分) 直线形(1分)
(3)Ca (1分) 8 (1分)
(4)ZnS (2分) 109o28′(1分)
(5)74% (1分);  (2分)
(2分) 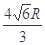 (2分)
(2分)
解析试题分析:A原子的最外层电子是次外层电子数的2倍,故A为碳,D为F,因为氟的电负性最强,则B为N、C为O,F和C在同一族,故F为硫,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,故F和G在第IIA,为镁和钙,应用最广泛的金属H为铁,在第二副族的I为锌;(1)氮气中氮氮三键,有1条ɑ键,故为1:2,同周期第一电离能从左向右逐渐增大,但氮为半充满,稳定,第一电离能大于氧,故为O<N<F;(2)铁的价电子排布为3d64s2,铁离子与SCN-形成络合物,价电子总数为16,分析可得价电子总数为16的分子为 CO2或CS2 或N2O,分析SCN-的结构可得中心原子碳和硫原子形成一条单键和氮原子形成三键,碳原子共形成2条ɑ键,无孤对电子,故为sp1杂化,直线型;(3)黑点位于面心和顶点,8×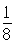 +6×
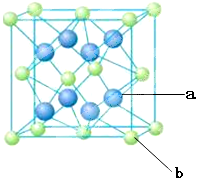
+6× =4,内部有8个,个数比为1:2,故黑点为钙,选取底面面心的钙,和它距离最近的下面晶胞上有4个,上面有4个,故配位数为8;(4)去掉4个之后变为个数比为1:1的离子化合物,为ZnS的晶体结构,换成一种原子之后,1个原子和四个相同的原子成键,形成正四面体结构,故键角为109o28′;(5)ABAB型六方最密堆积,设圆球半径为R,可以计算出晶胞参数:a="b=2R," c="1.633a," a="b=90°," g=120°
=4,内部有8个,个数比为1:2,故黑点为钙,选取底面面心的钙,和它距离最近的下面晶胞上有4个,上面有4个,故配位数为8;(4)去掉4个之后变为个数比为1:1的离子化合物,为ZnS的晶体结构,换成一种原子之后,1个原子和四个相同的原子成键,形成正四面体结构,故键角为109o28′;(5)ABAB型六方最密堆积,设圆球半径为R,可以计算出晶胞参数:a="b=2R," c="1.633a," a="b=90°," g=120°
空间利用率=晶胞中球的体积/晶胞体积= 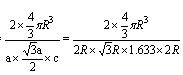 =74.06%;有三个晶胞构成的六棱柱的体积为3a2sin
=74.06%;有三个晶胞构成的六棱柱的体积为3a2sin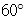 c,晶胞的质量为
c,晶胞的质量为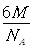 ,质量除以体积得密度为:
,质量除以体积得密度为: ;
; 正四面体的顶点即球心位置,棱长为圆球半径的 2 倍, 四面体的高 :
正四面体的顶点即球心位置,棱长为圆球半径的 2 倍, 四面体的高 :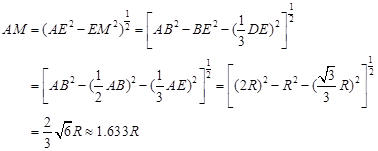
A3型晶胞中晶轴c 是2个四面体的高,即:c=2AM=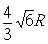 。
。
考点:根据原子结构及元素性质进行元素推断、晶胞的计算、配位数的分析、空间构型的判断等知识。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
下列说法正确的是( )
| A.含有共价键的化合物一定是共价化合物 |
| B.分子中只有共价键的化合物一定是共价化合物 |
| C.离子键就是阴、阳离子间相互吸引 |
| D.只有非金属原子间才能形成共价键 |
 4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。