题目内容
现有四种短周期元素X、Y、Z、W,其中:
① X、W原子的电子层数与最外层电子数之比分别为3:1和1:3
② Y原子是元素周期表中原子半径最小的
③ Z是形成化合物种类最多的元素
回答下列问题:
(1)X元素在周期表中的位置是 。
(2)上述四种元素中所能组成的含有非极性共价键的化合物的分子式 (填其中一种即可)。
(3)化合物X2W2的电子式是 。
(4)向含1 mol Na2SiO3的溶液中缓慢通入2 mol的ZO2,反应的离子方程式是 。
(5)由Y、Z、W元素中的两种或三种可以组成多种分子,其中含有10个电子的分子是_________(填化学式)。
(6)向25.00 mL的Y2Z2W4溶液中加入5.00 mL 0.50 mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物质的量浓度是 mol/L。
(12分每空二分)(1)第三周期、第ⅠA族 (2)H2O2或C2H6
(3)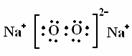 (4)2CO2 + 2 H2O + SiO32—=2 HCO3—+ H2SiO3↓
(4)2CO2 + 2 H2O + SiO32—=2 HCO3—+ H2SiO3↓
(5)H2O、CH4(6)0.25
解析试题分析:Y原子是元素周期表中原子半径最小的,则Y是氢元素。Z是形成化合物种类最多的元素,因此Z是碳元素。X、W原子的电子层数与最外层电子数之比分别为3:1和1:3,由于均是短周期元素,这说明X是第三周期元素,是钠元素。W是第二周期元素,是氧元素。
(1)Na元素的原子序数是11,在周期表中的位置是第三周期、第ⅠA族。
(2)上述四种元素中所能组成的含有非极性共价键的化合物的分子式H2O2或C2H6。
(3)化合物X2W2是过氧化钠,含有离子键和非极性键的离子化合物,电子式是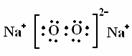 。
。
(4)碳酸的酸性强于硅酸的,则向含1 mol Na2SiO3的溶液中缓慢通入2 mol的CO2,反应的离子方程式是2CO2 + 2 H2O + SiO32—=2 HCO3—+ H2SiO3↓。
(5)由Y、Z、W元素中的两种或三种可以组成多种分子,其中含有10个电子的分子是H2O、CH4。
(6)在反应中碳元素的化合价从+3价升高到+4价,失去1个电子。锰元素的化合价从+7价降低到+2价,得到5个电子,所以根据电子的得失守恒可知,0.025L×c×2=0.005L×0.50mol/L×5,解得c=0.25mol/L。
考点:考查元素周期表第结构和元素周期律的应用以及常见化学用语的书写、氧化还原反应的计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案


 4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。