题目内容
【题目】高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分。
(1)NaClO4溶液和NH4Cl溶液混合后发生复分解反应,有NH4ClO4固体析出,写出该反应的化学方程式:____。
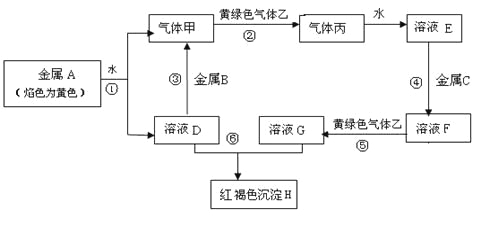
(2)通过如下图所示的装置及实验步骤可以测定某高氯酸铵样品的纯度。
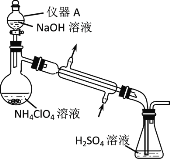
步骤1:检查装置气密性。
步骤2:准确称取样品0.2500 g于蒸馏烧瓶中,加入约150 mL水溶解。
步骤3:准确量取40.00 mL 0.1000 mol·L—1 H2SO4 溶液于锥形瓶中。
步骤4:经仪器A向蒸馏瓶中加入20 mL 3 mol·L—1NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用0.2000mol·L—1 NaOH标准溶液滴定至终点,消耗NaOH标准溶液30.00 mL。
步骤8:将实验步骤1~7重复2次。
①仪器A的名称是____。
②步骤1~7中,确保生成的氨被稀硫酸完全吸收的实验步骤是____(填步骤序号)。
③计算样品中高氯酸铵的质量分数____(写出计算过程,已知杂质不参与反应)。
【答案】NaClO4+NH4Cl=NH4ClO4↓+NaCl 分液漏斗 1、5、 6 n(NaOH)=0.2000 mol·L-1×30.00×10﹣3 L=0.006mol
由关系式“2 NaOH~H2SO4”可知,
过量的H2SO4的物质的量为:n(H2SO4)=![]() ×0.006mol=0.003 mol
×0.006mol=0.003 mol
与NH3反应的H2SO4的物质的量为:
n(H2SO4)=0.1000 mol·L-1×40.00×10﹣3 L-0.003 mol=0.001mol
由关系式“2 NH3~H2SO4”可知,
n(NH3)=2×0.001mol=0.002 mol
n(NH4ClO4)=n(NH3)=0.002 mol
m(NH4ClO4)=0.002 mol×117.5g·mol-1=0.235g
则样品中NH4ClO4的质量分数为:
ω(NH4ClO4)=0.235g÷0.2500 g×100%=94%
【解析】
(1)据信息,NaClO4溶液和NH4Cl溶液的复分解反应满足反应条件,反应物交换成分写出反应方程式;
(2). ①仪器A为分液漏斗;
②确保生成的氨被被硫酸完全吸收,气体不能泄漏,吸收剂要过量,不能在容器内残留;
③蒸馏烧瓶中NH4ClO4与NaOH溶液充分反应释放的NH3进入锥形瓶,在锥形瓶中被过量硫酸完全吸收,要计算样品中高氯酸铵的质量分数ω(NH4ClO4),需要计算纯高氯酸铵的质量m(NH4ClO4)、即要先计算n(NH4ClO4),因为n(NH4ClO4)=n(NH3),n(NH3)怎么算?H2SO4一部分用于吸收氨气,另一部分中和NaOH ,用于中和的那部分硫酸可通过滴定数据求得。
(1)NaClO4溶液和NH4Cl溶液的复分解反应有固体析出,化学方程式为NaClO4+NH4Cl=NH4ClO4↓+NaCl;
答案为:NaClO4+NH4Cl=NH4ClO4↓+NaCl;
(2). ①根据仪器A的构造,仪器A为分液漏斗,答案为:分液漏斗;
②确保生成的氨被硫酸完全吸收,应气密性好,尽可能完全反应,并冲洗冷凝管附着的氨水,所以为确保生成的氨被稀硫酸完全吸收的实验步骤为:1、5、6;
答案为:1、5、6;
③滴定消耗n(NaOH)=0.2000 mol·L-1×30.00×10﹣3 L=0.006mol
由关系式![]() 可知,
可知,
硫酸吸收氨气后过量的H2SO4的物质的量为:n(H2SO4)=![]() ×0.006mol=0.003 mol
×0.006mol=0.003 mol
与NH3反应的H2SO4的物质的量为:
n(H2SO4)=0.1000 mol·L-1×40.00×10﹣3 L-0.003 mol=0.001mol
由关系式![]() 可知,
可知,
n(NH3)=2×0.001mol=0.002 mol
n(NH4ClO4)=n(NH3)=0.002 mol
m(NH4ClO4)=0.002 mol×117.5g·mol-1=0.235g
则样品中NH4ClO4的质量分数为:
ω(NH4ClO4)=![]() =94%;
=94%;
答案为:94%。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】化学与生产、生活密切相关。下列有关物质的用途、性质都正确且有相关性的是
选项 | 用途 | 性质 |
A | 液氨作制冷剂 | NH3分解生成N2和H2的反应是吸热反应 |
B | NH4Fe(SO4)2·12H2O常作净水剂 | NH4Fe(SO4)2·12H2O具有氧化性 |
C | 漂粉精可以作环境消毒剂 | 漂粉精溶液中ClO-和HClO都有强氧化性 |
D | Al2O3常作耐高温材料 | Al2O3,既能与强酸反应,又能与强碱反应 |
A.AB.BC.CD.D
【题目】有同学研究从矿石开始到产出钢铁的工艺流程。
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3。求该铁矿石含铁的质量分数。___________
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)___________
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况),计算此钢样粉末中铁和碳的物质的量之比。___________
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度___________
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)___________