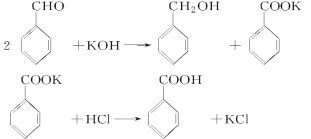
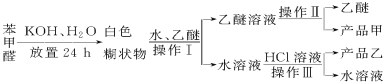
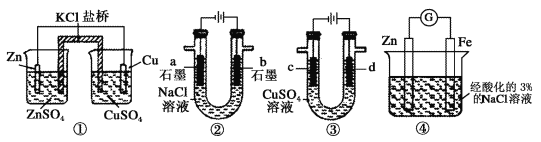
题目内容
【题目】多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
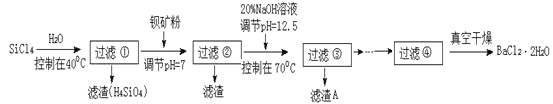
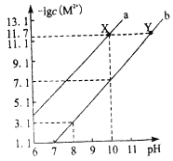
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解反应的化学方程式为_________________________________________________。过滤操作需要的玻璃仪器有_________________________________。
(2)加钡矿粉调节pH=7的作用是________________________、_______________________。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是_______________________。
(4)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(5)10吨含78.8 % BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_________吨。实际产量为9.70吨,相对误差为__________________%。
【答案】SiCl4+4H2O→H4SiO4↓+4HCl 烧杯、漏斗、玻璃棒 使BaCO3转化为BaCl2 使Fe3+完全沉淀 Mg(OH)2 蒸发浓缩 冷却结晶 9.76 -0.61
【解析】
(1)根据水解机理相当于水中的羟基取代了氯原子,即SiCl4水解反应的化学方程式为SiCl4+4H2O→H4SiO4↓+4HCl。过滤操作需要的玻璃仪器有烧杯、漏斗、玻璃棒。
(2)加钡矿粉调节pH=7的作用是使BaCO3转化为BaCl2,使Fe3+完全沉淀。
(3)根据题中信息,常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。加20% NaOH调节pH=12.5,主要是沉淀镁离子,得到滤渣A的主要成分是Mg(OH)2。
(4)BaCl2滤液经蒸发浓缩、冷却结晶,过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(5)反应关系式为
BaCO3~BaCl2·2H2O
197 244
10×78.8% m
m=![]() =9.76吨
=9.76吨
相对误差=![]() =-0.61%。
=-0.61%。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案