题目内容
【题目】有同学研究从矿石开始到产出钢铁的工艺流程。
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3。求该铁矿石含铁的质量分数。___________
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)___________
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况),计算此钢样粉末中铁和碳的物质的量之比。___________
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度___________
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)___________
【答案】0.51 1.97t 50︰1 1.25mol·L-1 ![]()
【解析】
试题(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3物质的量为0.03mol,铁的物质的量为0.06mol,故该铁矿石含铁的质量分数0.06*56/6.62= 0.51
(2)6.62g铁矿石中铁的质量为![]() ,生产l.00t生铁需要铁矿石的质量为:m(铁矿石)
,生产l.00t生铁需要铁矿石的质量为:m(铁矿石)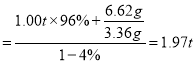 。
。
(3)![]() ,
,![]() ,
, 。
。
(4)根据实验Ⅲ可得:
![]()
1mol 22.4L
![]() 2.800L
2.800L
![]()
![]() 。
。
(5)当钢样粉末中的铁未全部溶解时(m>1.406g),剩余的固体质量为:(5.624g+mg)-0.125mol×56g·mol-1=(m-1.376)g,当钢样粉末中的铁全部溶解时(m≤1.406g),剩余的固体质量为:(5.624+m)g×![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4),它是一种重要的化工原料。(常温下0.01 mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示。)填空:
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
(1)写出H2C2O4的电离方程式________________。
(2)KHC2O4溶液显酸性的原因是_________________;向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______。
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失。写出反应的离子方程式____________________;又知该反应开始时速率较慢,随后大大加快,可能的原因是______________________。