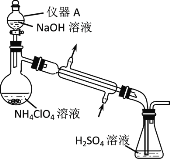
题目内容
【题目】常温下,用酚酞作指示剂,用 0.10mol·L-1NaOH 溶液分别滴定 20.00mL 浓度均为0.10mol·L-1的CH3COOH 溶液和 HCN 溶液所得滴定曲线如图。(已知电离平衡常数:CH3COOH> HCN)
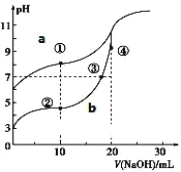
(1)图_____(a 或 b)是 NaOH 溶液滴定 HCN 溶液的 pH 变化的曲线。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:_____ 。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)_____c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)25 ℃时,用 0.1 mol·L-1的醋酸溶液滴定 20 mL 0.1 mol·L-1 的 NaOH 溶液,当滴加V mL 该醋酸溶液时, 混合溶液的 pH = 7 。已知醋酸的电离平衡常数为 Ka , 则Ka=________________
【答案】a c(Na+)=c(CH3COO-)>c(H+)=c(OH-) = ![]()
【解析】
(1)由图象可知,V(NaOH)=0时,a曲线对应的酸的pH大于b曲线,则a曲线对应的酸的电离程度小于b曲线,结合CH3COOH、HCN的电离平衡常数大小分析;
(2)根据电荷关系判断:溶液呈中性,则c(H+)=c(OH-),电荷关系为c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
(3)混合溶液中存在物料守恒,点①、点②c(Na+)相同,点①所示溶液中的物料守恒:c(HCN)+c(CN-)=2c(Na+)和点②所示溶液中的物料守恒:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据物料守恒分析判断;
(4)25 ℃时,用 0.1 mol·L-1的醋酸溶液滴定20 mL 0.1 mol·L-1的NaOH溶液,当滴加V mL 该醋酸溶液时,混合溶液的 pH =7时c(OH-)=c(H+),由电荷守恒式:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)可知c(CH3COO-)=c(Na+)=![]() mol/L,溶液中的c(CH3COOH)=
mol/L,溶液中的c(CH3COOH)=![]() mol/L,再结合Ka=
mol/L,再结合Ka=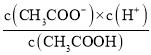 计算即可。
计算即可。
(1)由图象可知,V(NaOH)=0时,a曲线对应的酸的pH大于b曲线,则a曲线对应的酸的电离程度小于b曲线,由电离平衡常数:CH3COOH> HCN可知:酸的电离平衡常数越大,酸的酸性越强,pH越小,所以a曲线是NaOH溶液滴定HCN溶液的pH变化的曲线;
(2)溶液的电荷关系为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),点③所示溶液呈中性,c(H+)=c(OH-),所以溶液中所含离子浓度的从大到小的顺序为c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(3)点①和点②溶液中物料守恒得c(CH3COO-)+c(CH3COOH)=c(CN-)+c(HCN)=2c(Na+),所以有c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH);
(4)25 ℃时,用 0.1 mol·L-1的醋酸溶液滴定20 mL 0.1 mol·L-1的NaOH溶液,当滴加V mL 该醋酸溶液时,混合溶液的 pH =7时c(OH-)=c(H+)=10-7mol/L,由电荷守恒式:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)可知c(CH3COO-)=c(Na+)=![]() mol/L,溶液中的c(CH3COOH)=
mol/L,溶液中的c(CH3COOH)=![]() mol/L,则Ka=
mol/L,则Ka=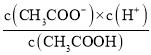 =
= =
=![]() 。
。

 目标测试系列答案
目标测试系列答案【题目】乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4),它是一种重要的化工原料。(常温下0.01 mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示。)填空:
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
(1)写出H2C2O4的电离方程式________________。
(2)KHC2O4溶液显酸性的原因是_________________;向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______。
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失。写出反应的离子方程式____________________;又知该反应开始时速率较慢,随后大大加快,可能的原因是______________________。